- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
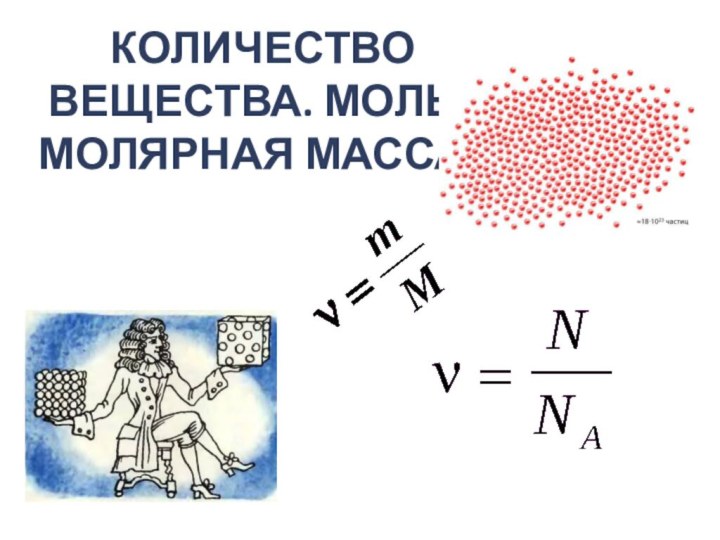
Презентация на тему по физике 10 класс Количество вещества
Содержание
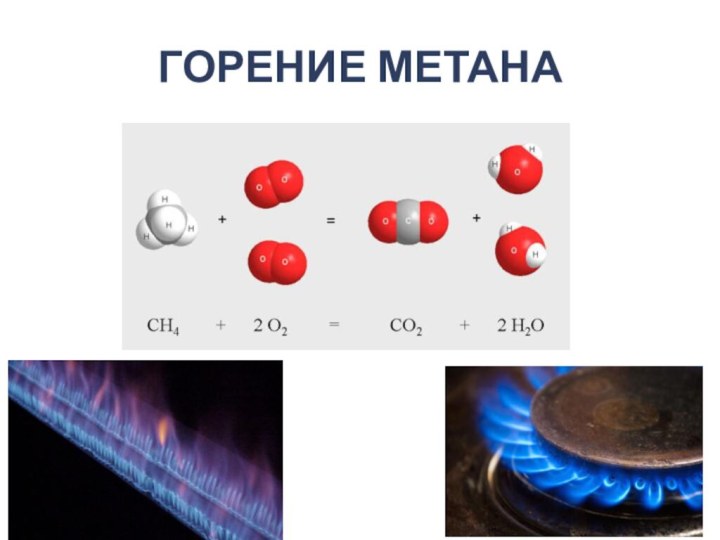
- 2. ГОРЕНИЕ МЕТАНА
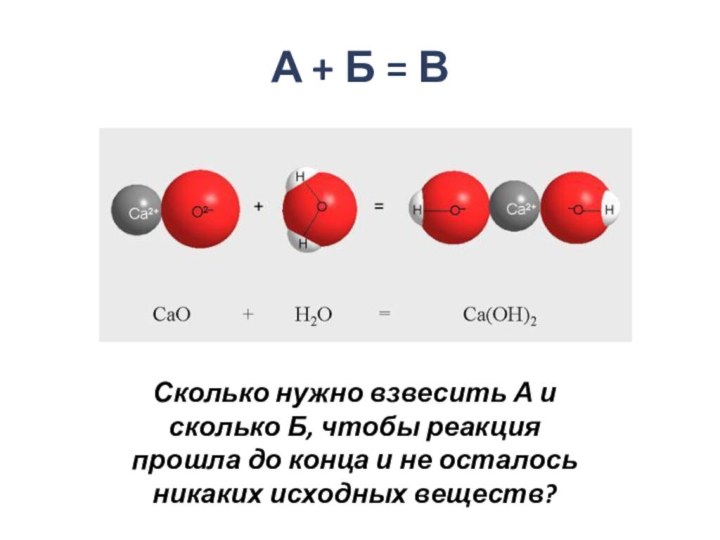
- 3. А + Б = ВСколько нужно взвесить А и
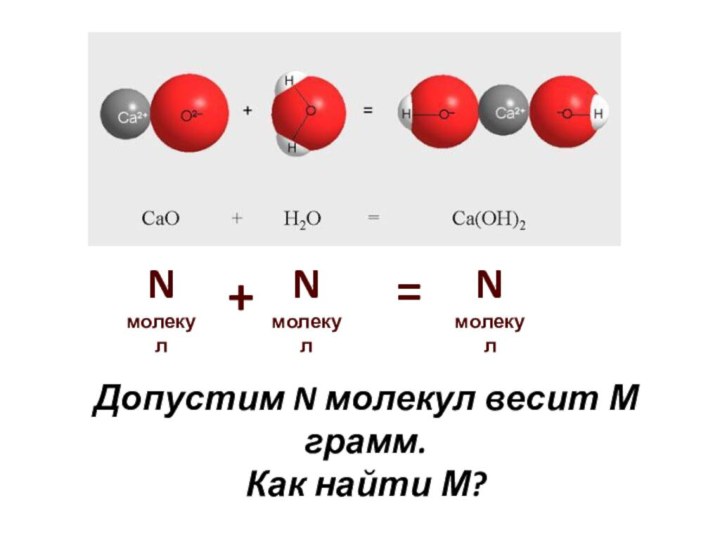
- 4. N молекулN молекулN молекул=+Допустим N молекул весит М грамм.Как найти М?
- 5. МАССА МОЛЕКУЛ СКЛАДЫВАЕТСЯ ИЗ МАСС СОСТАВЛЯЮЩИХ ЕЕ
- 6. 1 а.е.м. = 1,67.10-27 кг = 1,67.10-24 г. Тогда: 56.(1,67.10-24 г)
- 7. N – число молекул, с которым удобно
- 8. ПОСТОЯННАЯ АВОГАДРО NA = 6,02·1023 ИЛИ ЧИСЛО АВОГАДРОАмедео АвогадроИтальянский физик и химик(по образованию – юрист)
- 9. N - порция из 6.1023 частиц (молекул, атомов, ионов
- 10. НАПРИМЕР1 моль (1 М) воды = 6.1023 молекул
- 11. Количество вещества[n] = 1 мольn (или ν)Количество частицN
- 12. Масса одного моля какого-нибудь вещества (в граммах)
- 13. НАПРИМЕР
- 14. Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) n, по формуле: Отсюда ?
- 15. ЗАДАЧА 1Пользуясь значениями атомных весов элементов из
- 16. ЗАДАЧА 2Сколько молей кислорода содержится в 128
- 17. ЗАДАЧА 4Какое количество йода мы мажем на
- 18. ЗАДАЧА 6Одна порция дрожжей содержит 10,5 моль
- 19. МОЛЯРНЫЙ ОБЪЕМ ГАЗОВ. ЗАКОН АВОГАДРО.
- 20. Для газообразных веществ понятие моль имеет еще одну важную
- 21. РАВНЫЕ ОБЪЕМЫлюбых газов содержат РАВНОЕ ЧИСЛО МОЛЕКУЛ.Молекулы газов
- 22. ЗАКОН АВОГАДРОРавные объемы любых газов (при одинаковых
- 23. МОЛЯРНЫЙ ОБЪЕМ ГАЗОВVm = 22,4 л\мольПостоянная величина! Отсюда ? ТОЛЬКО ДЛЯ ГАЗОВ!!!!
- 24. ЗАДАЧА 1Какой объем при нормальных условиях (н.у.)
- 25. ЗАДАЧА 3В кислородной подушке при н.у. находится
- 26. ЗАДАЧА 5Вычислите плотность газа метана CH4 (г/л) при
- 27. Скачать презентацию
- 28. Похожие презентации






![Презентация по физике 10 класс Количество вещества Количество вещества[n] = 1 мольn (или ν)Количество частицN](/img/tmb/6/561576/88df590b49f940062931f8cf75c8d965-720x.jpg)















Слайд 5
МАССА МОЛЕКУЛ СКЛАДЫВАЕТСЯ ИЗ МАСС СОСТАВЛЯЮЩИХ ЕЕ АТОМОВ.
Атомный
вес кальция – 40 а.е.м.,
а атомный вес кислорода
– 16 а.е.м. Следовательно, молекулярный вес (молекулярная масса) СаО составит:
40 а.е.м. (Ca) + 16 а.е.м. (O) = 56 а.е.м. (CaO)
Слайд 6
1 а.е.м. = 1,67.10-27 кг = 1,67.10-24 г.
Тогда:
56.(1,67.10-24 г) =
93,5.10-24 г (масса 1 молекулы CaO)
93,5.10-24 г× 1 000 000 = 93,5× 10-18 г.
(масса
миллиона молекул)Точность лабораторных весов
1 мг (это всего лишь 10-3 г)
Слайд 7 N – число молекул, с которым удобно было
бы работать
m (протона) = 1 а.е.м.
1 частица (массой 1
а.е.м.) – весит 1,67.10-24 гN частиц – весят 1 г.
Отсюда:
Постоянная
Авогадро
Слайд 8
ПОСТОЯННАЯ АВОГАДРО NA = 6,02·1023
ИЛИ ЧИСЛО АВОГАДРО
Амедео Авогадро
Итальянский физик
и химик
(по образованию – юрист)
Слайд 9 N - порция из 6.1023 частиц (молекул, атомов, ионов и
т.д.).
Такие порции из 6.1023 структурных единиц вещества (атомов, молекул, ионов) называются МОЛЕМ вещества.
Таким
образом, МОЛЬ – это мера количества вещества. МОЛЬ - это КОЛИЧЕСТВО ВЕЩЕСТВА, равное 6,02.1023 структурных единиц данного вещества – молекул (если вещество состоит из молекул), атомов (если это атомарное вещество), ионов (если вещество является ионным соединением).
Слайд 10
НАПРИМЕР
1 моль (1 М) воды = 6.1023 молекул Н2О,
1
моль (1 М) железа = 6.1023 атомов Fe,
1 моль (1
М) хлора = 6.1023 молекул Cl2,1 моль (1 М) ионов хлора Cl- = 6.1023 ионов Cl-.
1 моль (1 М) электронов е- = 6.1023 электронов е-.
Слайд 12 Масса одного моля какого-нибудь вещества (в граммах) числено
совпадает с молекулярной или атомной массой этого вещества (в
а.е.м. или в безразмерном выражении - как в случае относительной атомной или молекулярной массы).Масса одного моля вещества называется МОЛЯРНОЙ МАССОЙ.
Молярная масса:
[M] = 1 г\моль
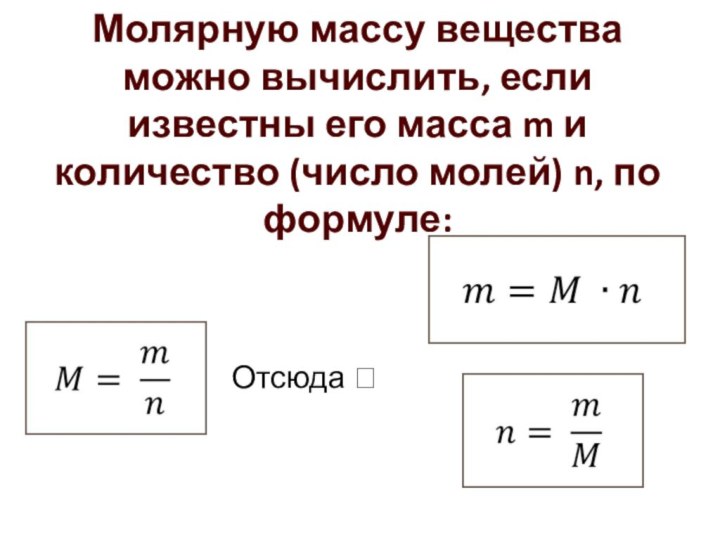
Слайд 14 Молярную массу вещества можно вычислить, если известны его
масса m и количество (число молей) n, по формуле:
Отсюда ?
Слайд 15
ЗАДАЧА 1
Пользуясь значениями атомных весов элементов из Периодической
таблицы, рассчитайте с точностью до целых чисел молекулярный вес
(а.е.м) и молярную массу (г) для следующих веществ: NaF, N2, NaOH, SO2.Сколько молекул содержится в 1 моле каждого из этих веществ?
Слайд 16
ЗАДАЧА 2
Сколько молей кислорода содержится в 128 г
кислорода? Сколько молекул кислорода содержится в этой массе?
ЗАДАЧА 3
В
стакан налили 180 г воды. Сколько молекул воды в стакане? Сколько это молей H2O?
Слайд 17
ЗАДАЧА 4
Какое количество йода мы мажем на разбитую
коленку, если общее число молекул составляет 38.1023 молекул?
ЗАДАЧА 5
Какое
количество углерода содержится в бриллианте, если общее число молекул составляет 180.1023 атомов?Сколько это по массе?
Слайд 18
ЗАДАЧА 6
Одна порция дрожжей содержит 10,5 моль вещества.
Сколько молекул дрожжей содержится в этой порции?
Сколько это в
граммах?ЗАДАЧА 7
Известно, что в одном гвозде содержится 5,5моль железа. Сколько атомов железа содержится в этом гвозде?
Слайд 20 Для газообразных веществ понятие моль имеет еще одну важную особенность:
такое количество частиц любого газа всегда занимает одинаковый объем.
HCl (газ) + NH3 (газ) =
NH4Cl (крист.)2 H2 + O2 = 2 H2O
(все вещества – газообразные)
H2 + Cl2 = 2 HCl
(все вещества – газообразные)
Жозеф Луи Гей-Люссак
Слайд 21
РАВНЫЕ ОБЪЕМЫлюбых газов содержат РАВНОЕ ЧИСЛО МОЛЕКУЛ.
Молекулы газов не
связаны между собой крепкими связями, как молекулы или атомы
твердых веществ.
Слайд 22
ЗАКОН АВОГАДРО
Равные объемы любых газов (при одинаковых температуре
и давлении) содержат равное число молекул.
1 МОЛЬ любого газа
при нормальных условиях (н.у.) занимает объем 22,4 л.
НОРМАЛЬНЫЕ УСЛОВИЯ (Н.у.): температура 0 оС (273 K) и давление 1 атм (760 мм ртутного столба или 101 325 Па).
Слайд 24
ЗАДАЧА 1
Какой объем при нормальных условиях (н.у.) занимают
56 г газообразного азота?
ЗАДАЧА 2
Какой объем при н.у. занимают
80 г газообразного аргона?
Слайд 25
ЗАДАЧА 3
В кислородной подушке при н.у. находится 6,72
л кислорода. Сколько это граммов кислорода? Сколько это молей
кислорода?ЗАДАЧА 4
Сколько молекул содержится в 60 г фтористого водорода (HF)? В каком объеме газообразного фтора (н.у.) содержится такое же число молекул?





























