- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Электрохимические процессы
Содержание
- 2. Химические процессы, которые сопровождаются возникновением электрического тока или протекают под действием электрического тока, называются электрохимическими процессами.
- 3. Гальванические элементыГальванический элемент - это устройство для преобразования химической энергии окислительно-восстановительной реакции в электрическую.
- 4. При окислительно-восстановительных реакциях (ОВР) происходит переход электронов
- 5. Электрохимические процессы, в которых химическая энергия превращается
- 6. Двойной электрический слой.Ме ⁿ+Ме ⁿ+Ме ⁿ+Ме ⁿ+Ме ⁿ+Ме ⁿ+
- 7. На границе металла – раствор возникает двойной
- 8. Данный процесс является обратимым. Потенциал, устанавливающий в условиях
- 9. На величину электродного потенциала влияют:1. природа металла;2. концентрация катионов, в растворе электролита;3. температура.
- 10. Количественно эта зависимость выражается уравнением Нернста:e =
- 11. n – число электронов, принимающих
- 12. Стандартный электродный потенциал – потенциал данного электрнода
- 13. Если расположить металлы в ряд в порядке
- 14. При работе гальванического элемента имеет место:движение электронов
- 15. ЭлементZn+²zn+2Cu+2sozn+2SO-42SO-42SO-42SO-42SO-42SO-42SO-42SO-42Даниэля-ЯкобиCuZnA(-)K(+)ZnSO4CuSO4SO-42SO-42SO-42SO-42SO-42
- 16. Гальванический элемент записывают в виде электрохимической схемы.
- 17. Максимальное напряжение, которое дает элемент (электродвижущую силу)
- 18. Концентрационные гальванические элементы
- 19. Типы гальванических элементов
- 20. Применение щелочных аккумуляторов в автокарах
- 21. Применение аккумуляторов Щелочные аккумуляторы используются в автокарах, в автопогрузчиках.Кислотные аккумуляторы – в автопромышленности.
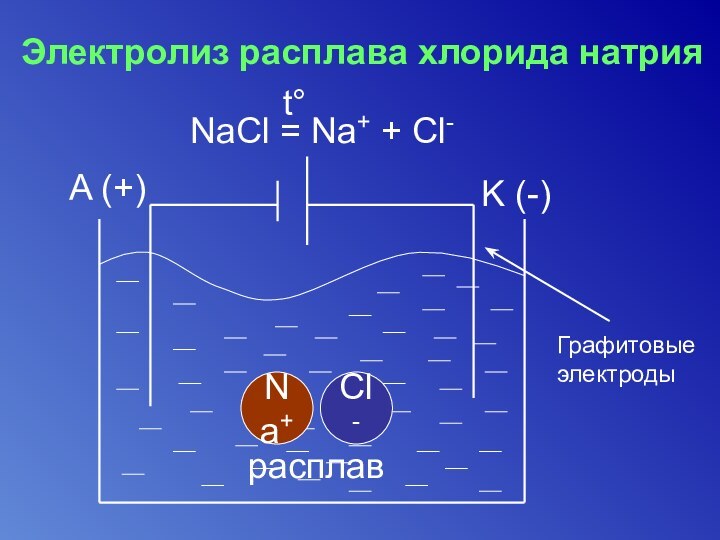
- 22. Электролизом называется окислительно-восстановительный процесс, протекающий на электродах
- 23. Электролиз расплава хлорида натрияNaCl = Na+ + Cl-t°A (+)K (-)Cl-Na+расплавГрафитовые электроды
- 24. КатодАнодК 2| Na+ + e-
- 25. Электролиз водных растворов электролитов Восстановление и окисление воды
- 26. Последовательность восстановления ионoв из водных растворов на
- 27. Из реакций Меm+ +
- 28. 2. Ионы металлических элементов,
- 29. Для ионов металлических элементов электродный потенциал которых
- 30. Последовательность окисления ионов из водных растворов на
- 31. Аноды подразделяются на инертные (нерастворимые), изготовляемые из
- 32. На инертном аноде возможно окисление анионов электролита
- 33. В первую очередь окисляются ионы йода /J-/
- 34. Например, из возможных процессов:2Н2О - 4е =
- 35. Например, при электролизе водного
- 36. Примеры электролиза водных растворов с инертным анодом.Пример
- 37. Электродный потенциал восстановления ионов Н+ из воды
- 38. Катод 1| 2H2O +
- 39. Катод 2| 2H2O +
- 40. Примеры электролиза водных растворов с активным анодом. CuSO4
- 41. Применение электролиза. Электролиз с активным анодом используют для
- 42. (примесей), то примеси остаются в растворе. Электролиз используется
- 43. КатализA + В = АВ ∆G
- 44. Гомогенный механизм2СO(Г) + О2 (Г) =
- 45. Молекулярный механизм2SO2(Г)+ О2 (Г) =
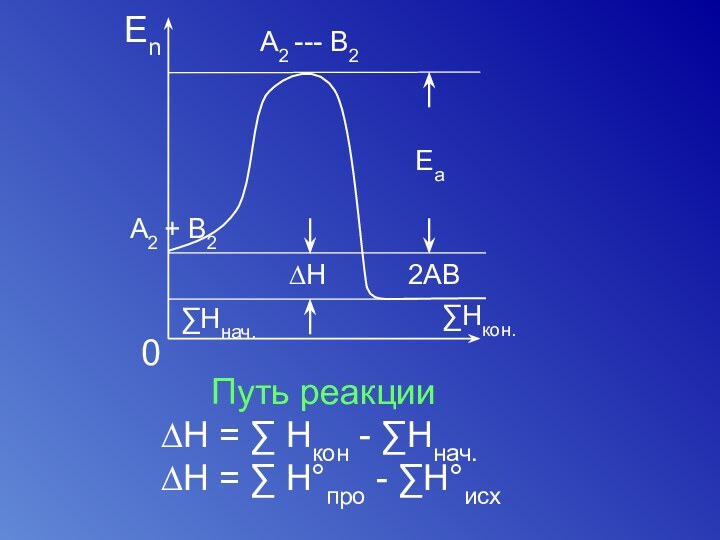
- 46. Гетерогенный2SO2(Г)+ О2 (Г) = 2SO3(Г)
- 47. Путь реакции[начальное] [переходное]
- 48. Путь реакции∆H = ∑ Hкон - ∑Hнач.∆H = ∑ H°про - ∑H°исх
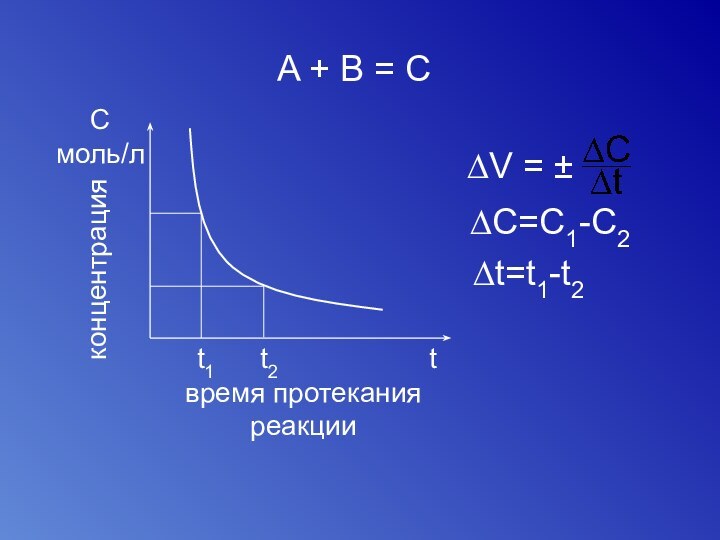
- 49. A + В = ССмоль/лtt1t2концентрациявремя протекания реакции∆V = ± ∆C=C1-C2∆t=t1-t2
- 50. Уравнение связывающие константу скорости с энергией активации и энтропией активации
- 51. Скачать презентацию
- 52. Похожие презентации









![Электрохимические процессы Количественно эта зависимость выражается уравнением Нернста:e = e0 + RT/nF Ln [Men+]где](/img/tmb/14/1399404/714e22d5c6ca5623fbc31b737a2729de-720x.jpg)

































![Электрохимические процессы Путь реакции[начальное] [переходное] [конечное]активированный комплексA2 + B2 =](/img/tmb/14/1399404/988bb7c2dc2bf52d51cb6f39581164d1-720x.jpg)

Слайд 2 Химические процессы, которые сопровождаются возникновением электрического тока или
протекают под действием электрического тока, называются электрохимическими процессами.
Слайд 3
Гальванические элементы
Гальванический элемент - это устройство для преобразования
химической энергии окислительно-восстановительной реакции в электрическую.
Слайд 4 При окислительно-восстановительных реакциях (ОВР) происходит переход электронов от
восстановителя к окислителю.
Если осуществить ОВР так, что полуреакции окисления
и восстановления будут пространственно разделены, то, если соединить восстановитель и окислитель металлическим проводником, мы получим направленное движение электронов - электрический ток. Слайд 5 Электрохимические процессы, в которых химическая энергия превращается в
электрическую, протекают в химических источниках электрической энергии (гальванический элемент,
аккумулятор, топливный элемент).Слайд 7 На границе металла – раствор возникает двойной электрический
слой.
Разность потенциалов на границе металла – раствор называется
электродным потенциалом, а система металл – раствор называется электродом.
Слайд 8
Данный процесс является обратимым.
Потенциал, устанавливающий в условиях равновесия
реакций окисления и восстановления на электроде, называется равновесным электродным
потенциалом.
Слайд 9
На величину электродного потенциала влияют:
1. природа металла;
2. концентрация
катионов, в растворе электролита;
3. температура.
Слайд 10
Количественно эта зависимость выражается уравнением Нернста:
e = e0
+ RT/nF Ln [Men+]
где е – равновесный электродный
потенциал, В; R – универсальная газовая постоянная, 8,31 Дж/моль OK;
e0 – стандартный электродный потенциал, В;
T – температура, °К;
Слайд 11
n – число электронов, принимающих
участие в процессе (заряд иона);
F – постоянная Фарадея,
96,500 Кл/моль. При температуре 25 °С (298 °К), переведя натуральный логарифм в десятичный, подставляя значение RT/F, будем иметь
e = e0 + 0.059/n Lg [Men+]
Слайд 12 Стандартный электродный потенциал – потенциал данного электрнода при
концентрации ионов в растворе 1,0 моль/л и температуре
25 °С (298 °К). Определяют относительные значения электродных потенциалов по водородной шкале. За нуль принято значение потенциала водородного электрода при стандартных условиях
2H+ + 2e-
e0H2/2H+ = 0 (В)
Слайд 13
Если расположить металлы в ряд в порядке возрастания
потенциалов, то получим ряд стандартных электродных потенциалов:
К/К+
-2.92
Na/Na+
-2.71 Mg/Mg2+
-2.36
Zn/Zn2+
-0.76
Fe/Fe2+
-0.44
H2/2H+
0
Cu/Cu2+
+0.34
Ряд стандартных электродных потенциалов дает количественную электрохимическую характеристику металлов.
Слайд 14
При работе гальванического элемента имеет место:
движение электронов по
внешней цепи – электронная проводимость;
движение ионов в растворе –
ионная проводимость.Суммарная уравнение ОВР в гальваническом элементе
Zn + Cu2+ = Zn2+ + Cu
Слайд 15
Элемент
Zn+²
zn+2
Cu+2
so
zn+2
SO-42
SO-42
SO-42
SO-42
SO-42
SO-42
SO-42
SO-42
Даниэля-Якоби
Cu
Zn
A(-)
K(+)
ZnSO4
CuSO4
SO-42
SO-42
SO-42
SO-42
SO-42
Слайд 16 Гальванический элемент записывают в виде электрохимической схемы. Схемы
элемента Якоби-Даниэля
A (-) Zn | ZnSO4||CuSO4| Cu (+) K
Краткая
схемаA (-) Zn | Zn2+ || Cu2+ | Cu (+) K
Слайд 17
Максимальное напряжение, которое дает элемент (электродвижущую силу) рассчитывают
Э.Д.С.
= eкатода - eанода
Э.Д.С. элемента Якоби – Даниэля для
стандартных условийЕ0 = (0,34) – (-0,76) = 1,10 В
Слайд 21
Применение аккумуляторов
Щелочные аккумуляторы используются в автокарах, в автопогрузчиках.
Кислотные
аккумуляторы – в автопромышленности.
Слайд 22
Электролизом
называется окислительно-восстановительный процесс, протекающий на электродах при
прохождении постоянного электрического тока через расплав или раствор электролита.
Слайд 23
Электролиз расплава хлорида натрия
NaCl = Na+ + Cl-
t°
A
(+)
K (-)
Cl-
Na+
расплав
Графитовые электроды
Слайд 24
Катод
Анод
К 2| Na+ + e- =
Na
A 1| 2Cl- - 2e- = Cl2
2Na+ +
2Cl- = 2Na + Cl22NaCl = 2Na + Cl2
Таким образом, при электролизе может быть получен металлический натрий и газообразный хлор.
Слайд 25
Электролиз водных растворов электролитов
Восстановление и окисление воды при
этом может идти по уравнению:
на катоде 2Н2О +
2е- = Н2 + 2ОН-на аноде 2Н2О - 4е- = О2 + 4Н+
Слайд 26 Последовательность восстановления ионoв из водных растворов на катоде
зависит от величины электродного потенциала восстановления катионов электролита и
электродного потенциала восстановления воды (ионов водорода из воды). Электродный потенциал восстановления воды равен (-0,41В).На катоде в первую очередь восстанавливаются ионы с более высоким значением электродного потенциала.
Слайд 27 Из реакций Меm+ + me-
= Me
2Н2О + 2е = Н2 + 2ОН- е
= -0,41 (В)возможны следующие случаи:
Ионы металлических элементов, электродный потенциал которых больше -0,41 (В). Восстанавливаются только ионы металлических элементов Меm+ + me- = Me
Слайд 28 2. Ионы металлических элементов, электродный
потенциал которых меньше -0,41 (В). В первую очередь
восстанавливаются ионы водорода из воды 2Н2О + 2е = Н2 + 2ОН-
Слайд 29 Для ионов металлических элементов электродный потенциал которых от -1,18
(В) до -0,41 (В) (от AL3+ до Cd2+) возможно
одновременное восстановление ионов водорода из воды и ионов металлических элементов Меm+ + mе- = Me2Н2О + 2е = Н2 + 2ОН-
Слайд 30 Последовательность окисления ионов из водных растворов на аноде
зависит от величины электродного потенциала окисления анионов электролита, электродного
потенциала окисления воды и также вещества, из которого сделан анод.Слайд 31 Аноды подразделяются на инертные (нерастворимые), изготовляемые из угля,
кокса, графита или платины, и растворимые, изготовляемые, как правило,
из металла, соли которого подвергаются электролизу.На аноде в первую очередь окисляются молекулы, атомы, ионы, которые имеют наименьшее значение потенциала.
Слайд 32 На инертном аноде возможно окисление анионов электролита или
окисление воды.
Анионы бескислородных кислот /S2-, Сl-, Вг-, J-/ окисляются
в первую
очередь, так как потенциал окисления этих анионов ниже потенциала
окисления воды.Например, из возможных процессов: 2J- - 2e- = J2 e0 = +0,54 (В)
2Н2О - 4е = О2 +4Н+ е0 = +1,23 (В)
Слайд 33 В первую очередь окисляются ионы йода /J-/ с
выделением молекулярного йода /J2/
2J- - 2е- = J2
2. Если же
раствор содержит анионы кислородосодержащих кислот
(NО3- , СО32-, SO42-, РО43-, SO32-), то в первую очередь окисляются молекулы воды, так как потенциал окисления воды ниже потенциала окисления этих анионов.
Слайд 34
Например, из возможных процессов:
2Н2О - 4е = О2
+ 4Н+ е0 = +1.23 (В)
2SO42- - 2е-
= S2O82- е0 = +2.01 (В)В первую очередь окисляются молекулы воды с выделением молекулярного кислорода
Н2О - 4е- = О2 + 4Н+
На растворимом аноде происходит окисление вещества, из которого изготовлен анод, так как этот процесс имеет наиболее низкое значение потенциала.
Слайд 35 Например, при электролизе водного
раствора сульфата меди с медным анодом
возможны процессы:Сu - 2е- = Сu2+ е0 = +0.34 (В)
2Н2О - 4е = О2 + 4Н+ е0 = +1.23 (В)
2SO42- - 2е- = S2O82- е0 = +2.01 (В)
В первую очередь окисляется сам анод
Сu – 2e- = Сu2+
Слайд 36
Примеры электролиза водных растворов с инертным анодом.
Пример 1.
NaJ
= Na+ + J-
Н2О
Н+ + ОН-К (-) (+) А
Na+, H+ (H2O) J-, ОН- (Н2О)
Электродный потенциал восстановления ионов Na+ e0Na/Na+= -2.71 (В)
Слайд 37 Электродный потенциал восстановления ионов Н+ из воды e2H+/H2
= -0,41 (В). Поэтому в первую очередь на катоде
восстанавливаются ионы водорода из воды. На аноде в первую очередь окисляются ионы йода, так как потенциал окисления этих анионов ниже потенциала окисления воды.Слайд 38 Катод 1| 2H2O + 2e-
= H2 + 2OH-
Анод 1|
2J- - 2e- = J22H2O + 2J- = H2 +J2 + 2OH-
2H2O + 2NaJ = H2 + J2 + 2NaOH
Пример 2.
K2SO4 = 2K+ + SO-24
H2O H+ + OH-
K (-) (+) A
K+, H+ (H2O) SO-24, OH- (H2O)
Слайд 39 Катод 2| 2H2O + 2e-
= H2 + 2OH-
Анод 1|
2H2O - 4e- = O2 + 4H+4H2O + 2H2O = 2H2 + O2 + 4OH- + 4H+
2H2O = 2H2 + O2
Электролиз с инертным анодом используют для получения водорода, кислорода, а также металлов (медь, цинк, кадмий, никель и др.) из растворов солей.
Слайд 40
Примеры электролиза водных растворов с активным анодом.
CuSO4
= Cu+ + SO-24
Н2О
Н+ + ОН-К (-) (+) А
Cu+, H+ (H2O) SO-24, ОН- (Н2О), Cu
Катод Cu2+ + 2e- = Cu
Анод Cu – 2e- = Cu2+
Cu2+ + Cu = Cu2+ + Cu
Слайд 41
Применение электролиза.
Электролиз с активным анодом используют для очистки
(рафинирования) металлов (меди, золота, серебра, свинца, олова и др.).
На аноде растворяются основной металл и примеси. На катоде в первую очередь выделяются металлы, имеющие наиболее положительный потенциал. Так как потенциалы серебра, меди, олова, свинца положительнее, чем потенциалы многих других металлов
Слайд 42
(примесей), то примеси остаются в растворе.
Электролиз используется для
нанесения металлических покрытий на металлы (гальваностегия), а также, для
получения точных металлических копий с различных предметов (гальванопластика).
Слайд 43
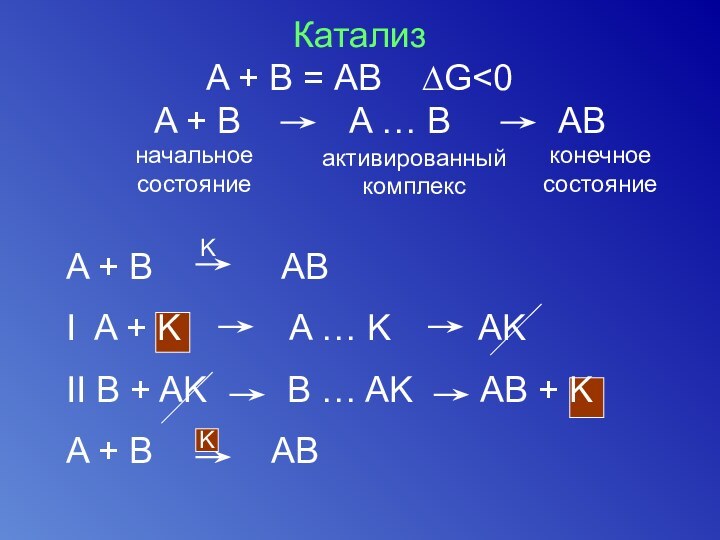
Катализ
A + В = АВ ∆G
A + B
A … B ABначальное
состояние
активированный
комплекс
конечное
состояние
K
K
A + B AB
I A + K A … K AK
II B + AK B … AK AB + K
A + B AB
Слайд 44
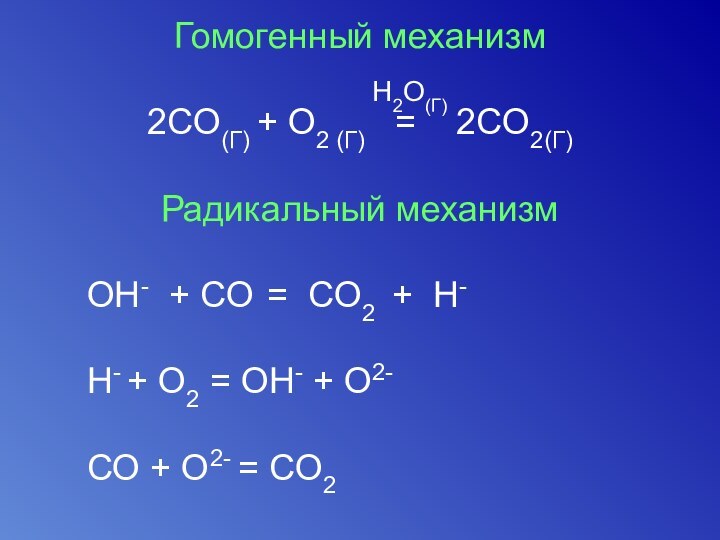
Гомогенный механизм
2СO(Г) + О2 (Г) =
2СO2(Г)
Радикальный механизм
OH- + CO =
CO2 + H-H- + O2 = OH- + O2-
CO + O2- = CO2
H2O(Г)
Слайд 45
Молекулярный механизм
2SO2(Г)+ О2 (Г) = 2SO3(Г)
– гомоген.
I NO + 1/2
+ O2 = NO2II NO2 + SO2 = SO3 + NO
NO(Г)
Слайд 46
Гетерогенный
2SO2(Г)+ О2 (Г) = 2SO3(Г)
5
стадий
1. транспорт вещества к поверхности катализатора
2.
адсорбция3. реакция на поверхности катализатора
4. десорбция
5. транспорт вещества с поверхности катализатора
V2O5(тв)
Слайд 47
Путь реакции
[начальное] [переходное] [конечное]
активированный
комплекс
A2 + B2 = 2AB
∆G<0A – A A -|- A A A
B – B B -|- B B B
+
¦
¦
+
начальное
переходное
(активированный
комплекс)
конечное