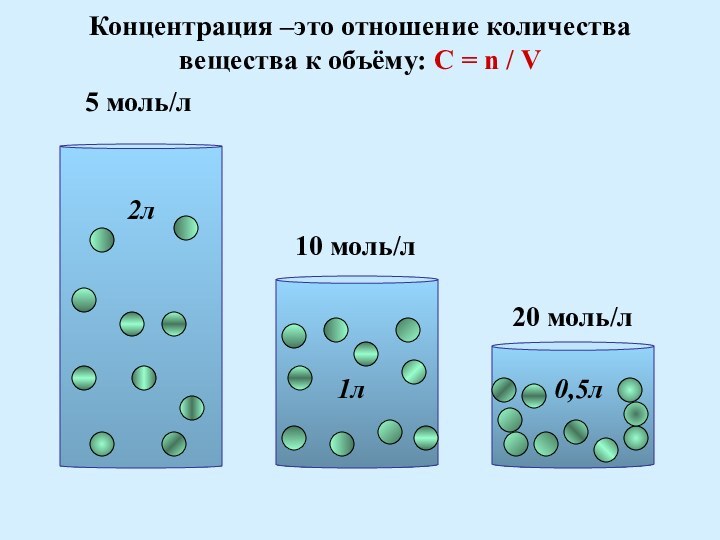
= n / V
5 моль/л
2л
10 моль/л
20 моль/л
1л 0,5л
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть



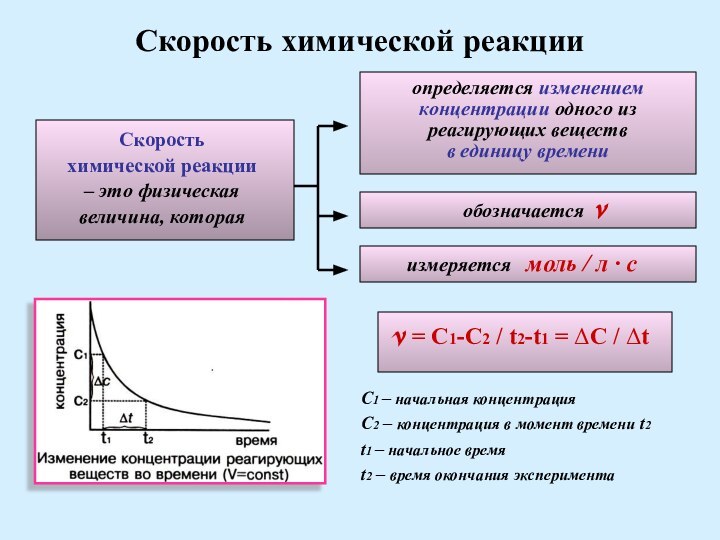













обозначается v
измеряется моль / л · с
v = C1-C2 / t2-t1 = ΔC / Δt
C1 – начальная концентрация
C2 – концентрация в момент времени t2
t1 – начальное время
t2 – время окончания эксперимента
Факторы, влияющие на скорость
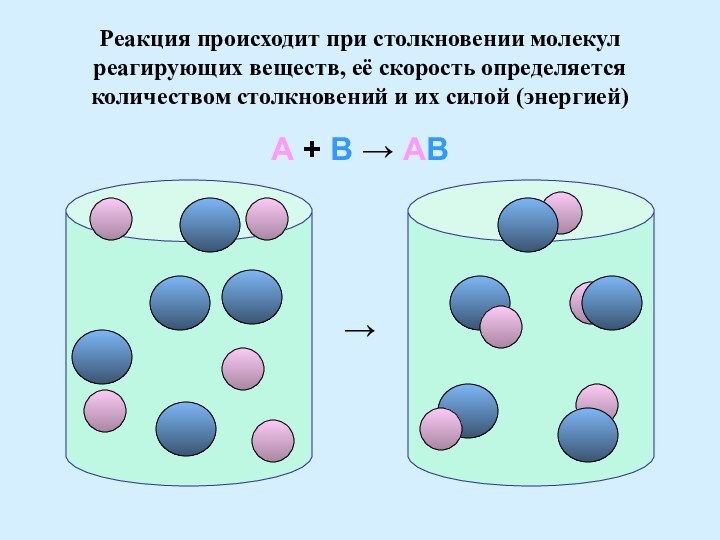
А
│
А
+
В
│
В
А . . . . . А
· ·
· ·
· ·
· ·
· ·
В . . . . . В
А А
│ + │
В В
В + АК → В…А…К → АВ + К
активированный
комплекс
А + К → АК
В + АК → АВ + К
А + В → АВ
Реакция протекает
быстро, Еа - мала
Вещество К приняло участие в процессе, но в результате осталось химически неизменным (катализатор)