уровни электрона в атоме.
n = 1,2,3,…L = n
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть



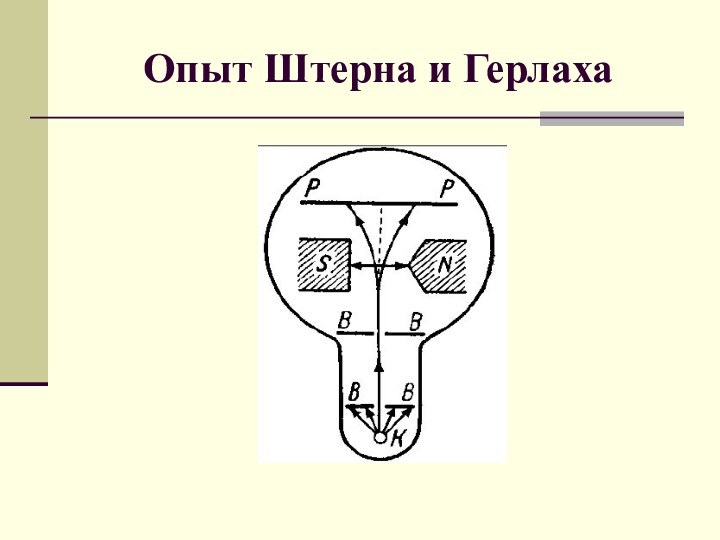
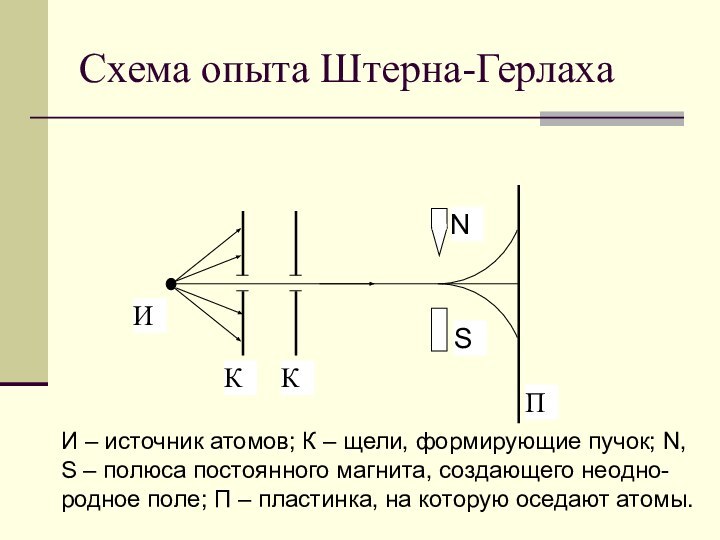










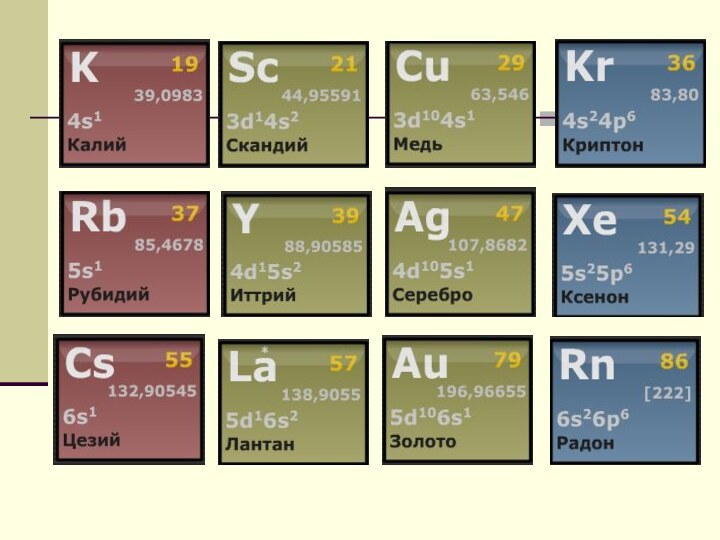
l = 0 – s-состояние
l = 1 – p-состояние
l = 2 – d-состояние
l = 3 – f-состояние
l = 4 – g-состояние
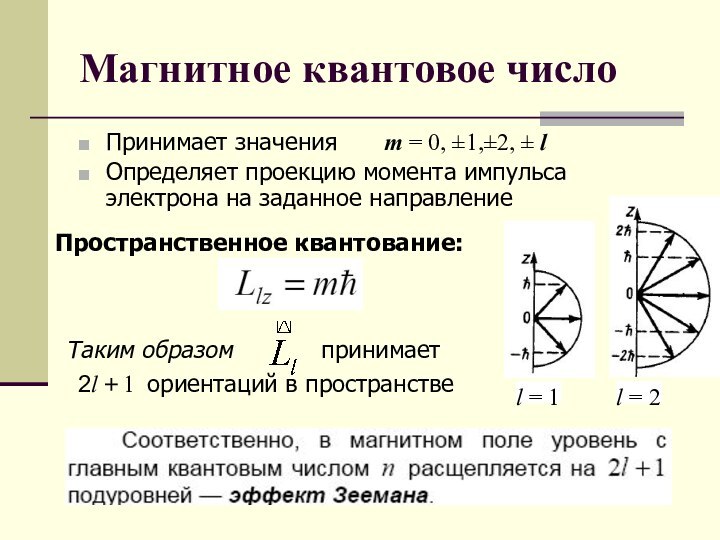
Пространственное квантование:
Таким образом
принимает
2l + 1 ориентаций в пространстве
ms = ± ½ - магнитное спиновое квантовое число,
Проекция спина на внешнее магнитное поле квантуется
Д. Уленбек, С.Гаудсмит
Z(n, l, m, ms) =0 или 1
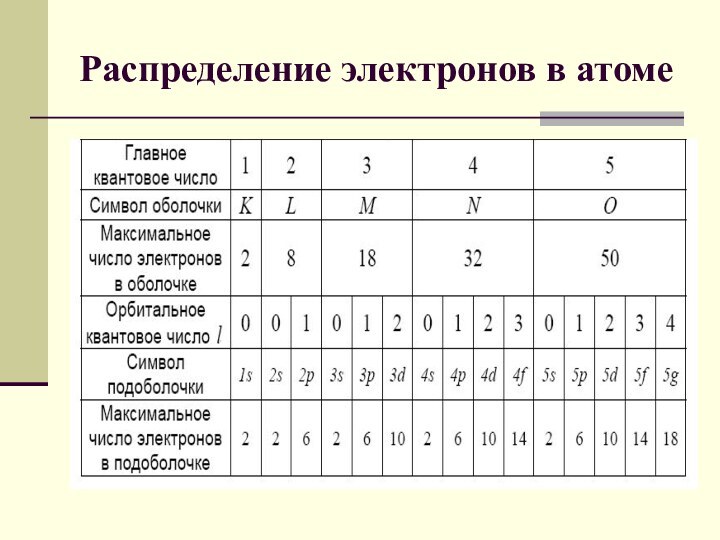
В каждой из оболочек электроны распределяются по подоболочкам, соответствующим данному l