- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Основные газовые законы
Содержание
- 2. Цели урока:изучить газовые законы; научиться объяснять законы
- 3. Что является объектом изучения МКТ? Что в
- 4. Изопроцессы в газахПроцессы, протекающие при неизменном значении одного из параметров, называют изопроцессами.Рассмотрим следующие изопроцессы:
- 5. Газовый закон –количественная зависимость
- 6. План изучения нового материала Определение процесса, история открытияУсловия примененияФормула и формулировка законаГрафическое изображениеПример проявления
- 7. процесс изменения состояния термодинамической системы макроскопических тел
- 8. Закон Бойля-Мариотта справедлив для любых газов, а
- 9. Применение закона Бойля-Мариотта Газовые
- 10. При дыхании межреберные мышцы и
- 11. Применение закона Бойля-Мариотта Другими
- 12. процесс изменения состояния термодинамической системы макроскопических тел
- 13. Пример проявления Расширение газа в цилиндре с подвижным поршнем при нагревании цилиндра
- 14. процесс изменения состояния термодинамической системы макроскопических тел
- 15. Пример проявления Нагревание газа любой закрытой емкости, например в электрической лампочке при ее включении.
- 17. Если взять произвольную
- 18. Особенность газообразного состояния1. В свойствах газов:
- 19. Использование свойств газов в технике
- 20. Использование свойств газов в технике В
- 21. ОбобщениеPV = m/M·RTP1V1 = P2V2V = constT = constP = const
- 22. (Название процесса)
- 23. (Название процесса)
- 24. (Название процесса)
- 25. Ответы 1 –вар Ответы 2 -вар
- 26. Домашнее заданиеЖданов: § 4.3 – 4.6
- 27. Скачать презентацию
- 28. Похожие презентации
























Слайд 2
Цели урока:
изучить газовые законы;
научиться объяснять законы с
молекулярной точки зрения;
аналитические задачи, используя уравнение состояния и газовые законы.
Слайд 3
Что является объектом изучения МКТ?
Что в МКТ
называют идеальным газом?
Для того чтобы описать состояние идеального газа
используют три термодинамических параметра. Какие? Назовите микроскопические параметры идеального газа и макроскопические параметры.
Как создаётся давление?
Как термодинамический параметр давления связан с микроскопическими параметрами?
Как объём связан с микроскопическими параметрами?
Слайд 4
Изопроцессы в газах
Процессы, протекающие при неизменном значении
одного
из параметров, называют изопроцессами.
Рассмотрим следующие изопроцессы:
Слайд 5 Газовый закон –количественная зависимость между двумя термодинамическими параметрами
газа при фиксированном значении третьего.
Газовых закона, как
и изопроцесса – три. Первый газовый закон был получен в 1662 году физиками Бойлем и Мариоттом,
Уравнение состояния – в 1834 году Клапейроном,
а более общая форма уравнения – в 1874 году Д.И.Менделеевым.
Слайд 6
План изучения нового материала
Определение процесса, история открытия
Условия применения
Формула
и формулировка закона
Графическое изображение
Пример проявления
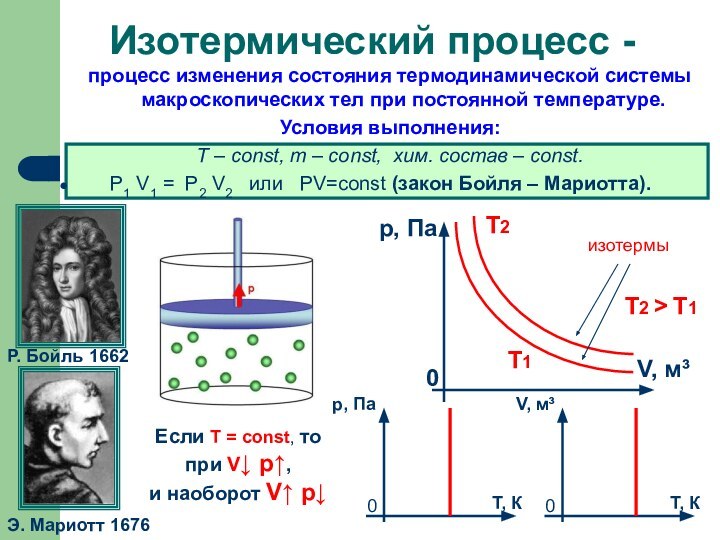
Слайд 7
процесс изменения состояния термодинамической системы макроскопических тел при
постоянной температуре.
Условия выполнения:
Т – const, m – const,
хим. состав – const. Р1 V1 = Р2 V2 или РV=соnst (закон Бойля – Мариотта).
Изотермический процесс -
Р. Бойль 1662
Э. Мариотт 1676
Если T = const, то
при V↓ p↑,
и наоборот V↑ p↓
изотермы
Т2
Т1
Т2 > Т1
Слайд 8 Закон Бойля-Мариотта справедлив для любых газов, а так
же и для их смесей, например, для воздуха.
Пример проявления:
А)
сжатие воздуха компрессором Б) расширение газа под поршнем насоса при откачивании газа из сосуда.
Слайд 9
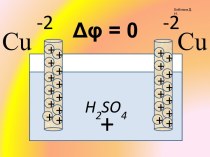
Применение закона Бойля-Мариотта
Газовые законы
активно работают не только в технике, но и в
живой природе, широко применяются в медицине.Закон Бойля-Мариотта начинает «работать на человека» (как, впрочем, и на любое млекопитающее) с момента его рождения, с первого самостоятельного вздоха.
Слайд 10 При дыхании межреберные мышцы и диафрагма
периодически изменяют объем грудной клетки. Когда грудная клетка расширяется,
давление воздуха в легких падает ниже атмосферного, т.е. «срабатывает» изотермический закон (pV=const), и в следствие образовавшегося перепада давлений происходит вдох.Применение закона
Бойля-Мариотта
Слайд 11
Применение закона
Бойля-Мариотта
Другими словами воздух
идет из окружающей среды в легкие самотеком до тех
пор, пока величины давления в легких и в окружающей среде не выровняются.Выдох происходит аналогично: вследствие уменьшения объема легких давление воздуха в них становится больше, чем внешнее атмосферное, и за счет обратного перепада давлений он переходит наружу.
Слайд 12
процесс изменения состояния термодинамической системы макроскопических тел при
постоянном давлении.
Условия выполнения
Р – const, m – const,
хим. состав – const V1 / T1 = V2 / T2. V/Т = const (закон Гей-Люссака).
Изобарный процесс -
Ж. Гей-Люссак 1802
Если р = const, то
при Т↓ V↓,
и наоборот T↑ V↑
изобары
р2
р1
р2 < р1
Слайд 14
процесс изменения состояния термодинамической системы макроскопических тел при
постоянном объеме.
Условия выполнения:
V – const, m – const,
хим. состав – const.p/Т = const или P1 / T1 = P2 / T2 (закон Шарля).
Изохорный процесс -
Ж. Шарль 1787
Если V = const, то
при Т↓ p↓,
и наоборот T↑ p↑
Изохоры
V2
V1
V2 < V1
р↑
Слайд 15
Пример проявления
Нагревание газа любой закрытой емкости, например
в электрической лампочке при ее включении.
Слайд 16 1834г. Французский физик Клапейрон, работавший длительное время в
Петербурге, вывел уравнение состояния идеального газа при постоянной массе
газа ( m=const).Р= n0 к T – основное уравнение М.К.Т., так как
n0 – число молекул в единице объема газа
n0 = N/V N - общее число молекул
т.к. m=const, N - остается неизменным (N= const)
P= NкT/V или PV/T = Nⱪ
где Nк - постоянное число, то
PV/T = const P1V1 / T1 = P2V2 / T2 - уравнение Клапейрона
Слайд 17 Если взять произвольную массу газа m при любых
условиях, то уравнение Клапейрона примет вид:
PV = m/M·RT-
уравнение
Клапейрона-МенделееваЭто уравнение в отличии от предыдущих газовых законов связывает параметры одного состояния. Оно применяется, когда в процессе перехода газа из одного состояния в другое меняется масса газа.
Слайд 18
Особенность газообразного состояния
1. В свойствах газов:
-
Управление давлением газа
- Большая сжимаемость
-
Зависимость p и V от Т2. Использование свойств газов в технике.
Слайд 19
Использование свойств газов в технике
Газы
в технике, применяются главным образом в качестве топлива; сырья
для химической промышленности: химических агентов при сварке, газовой химико-термической обработке металлов, создании инертной или специальной атмосферы, в некоторых биохимических процессах. Газы также применяют в качестве амортизаторов (в шинах), рабочих тел в двигателях (тепловых на сжатом газе), двигателях внутреннего сгорания.
Слайд 20
Использование свойств
газов в технике
В огнестрельном оружии
для выталкивания пули из ствола. В качестве теплоносителей; рабочего
тела для выполнения механической работы (реактивные двигатели и снаряды, газовые турбины, парогазовые установки, пневмотранспорт и др.), физической среды для газового разряда (в газоразрядных трубках и др. приборах).В технике используется свыше
30 различных газов.
Слайд 25
Ответы 1 –вар Ответы 2 -вар
V
–ув, T 2
T=constT – ув P- ув T
P=const 1 P V-ум 2 1
P
Р
2 V
1 2
1 V
V
Слайд 26
Домашнее задание
Жданов: § 4.3 – 4.6
§ 5.1 –
5.10Дмитриева: § 12 – 16
Гладкова «Сборник задач» № 3.18, 3.43