- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Основные сведения о строении атомов
Содержание
- 3. Понятие атом возникло ещё в античном мире для обозначения частиц вещества.
- 4. Ученые древности о строении веществаДревнегреческий ученый Демокрит
- 5. СТОНЕИ (Стони) Джордж Джонстон (Stoney George Johnstone)
- 6. История открытия строения атома.Уильям КруксВ 1879 году открыл катодные лучи.
- 7. Джозеф Томсон и Жан Перрен доказали, что электроны несут на себе отрицательный зарядДжозеф ТомсонЖан Перрен
- 8. История открытия строения атома.Дж. Томсон.Доказал, что электроны
- 10. Открытие радиоактивностиАнри БеккерельРасщепление радиоактивного излучения
- 11. Эрнест РезерфордВ 1910 г. Эрнест Резерфорд со
- 12. Доказал, что атом имеет плотное ядро. Предложил планетарную теорию строения атома.Э. Резерфорд
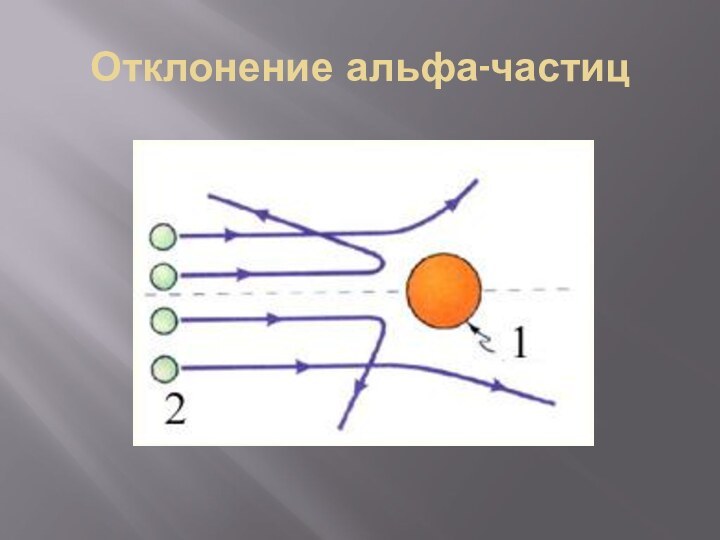
- 15. Отклонение альфа-частиц
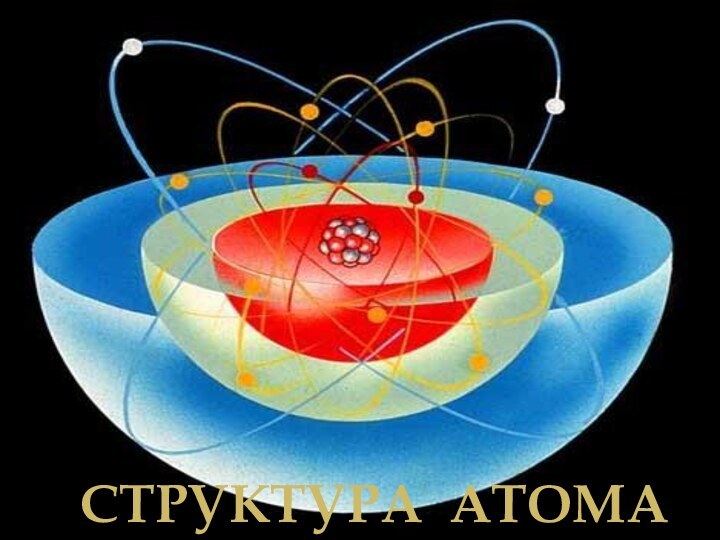
- 16. Структура атома
- 17. В 1911 г. английский ученый Э. Резерфорд
- 18. Планетарная модель строения атома Резерфорд предположил,
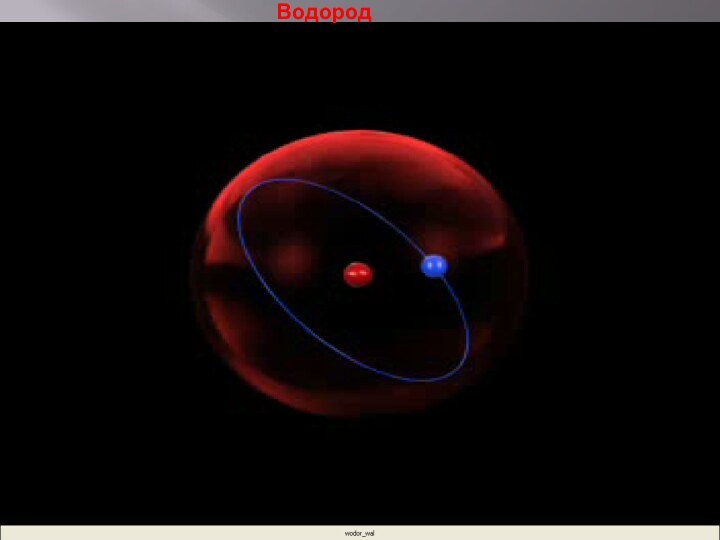
- 19. Водород
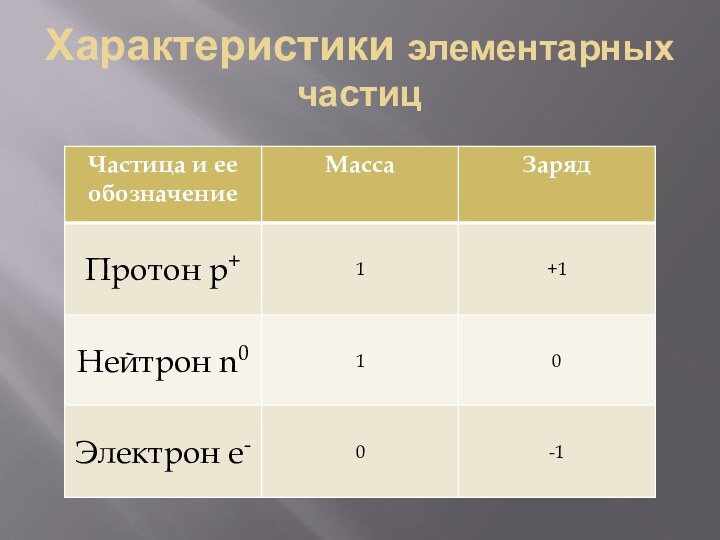
- 21. Характеристики элементарных частиц
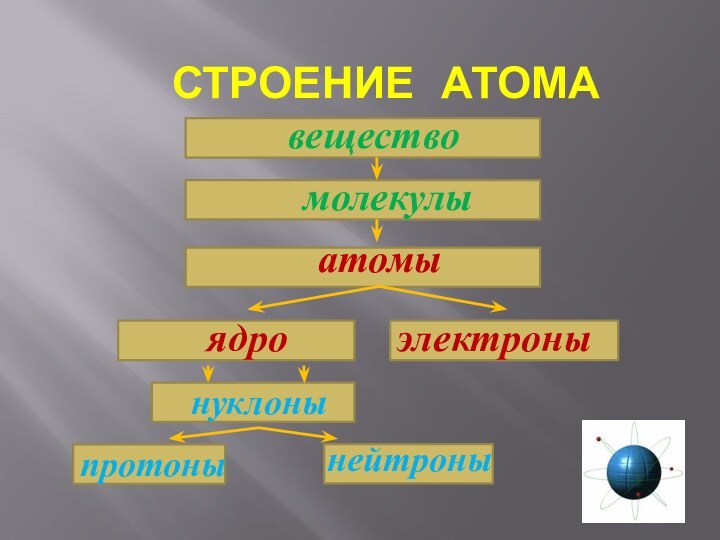
- 22. СТРОЕНИЕ АТОМА веществомолекулыатомынуклоны
- 23. Число протонов
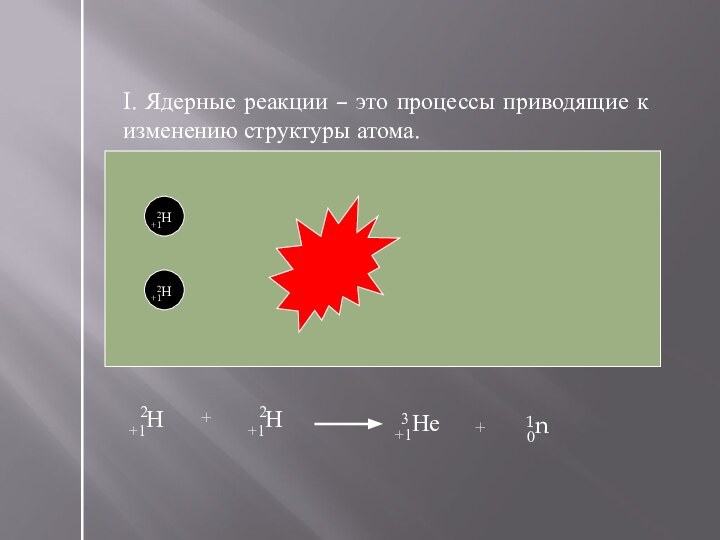
- 24. Изменение в составе ядер атомов химических элементов.Ядерные реакции. Изотопы
- 25. I. Ядерные реакции – это процессы приводящие к изменению структуры атома.+1Н2+1Н2+1Не30n1+1Н2+1Н2++1Не30n1+
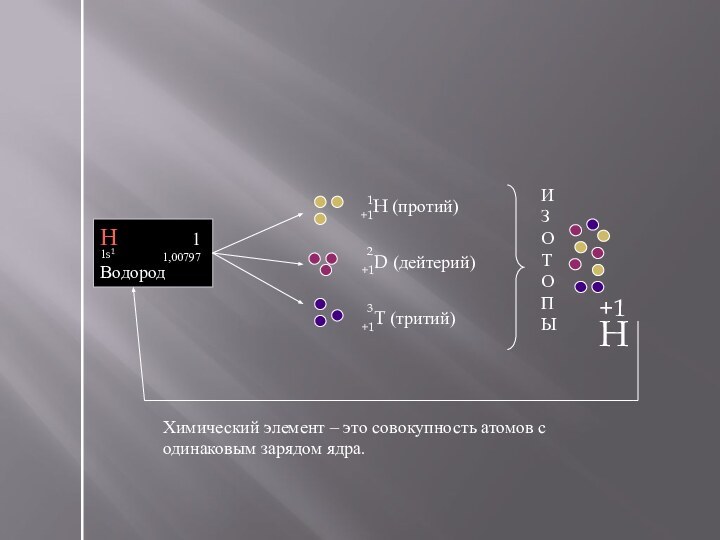
- 27. +1H (протий) +1D (дейтерий)+1T (тритий)Химический элемент – это совокупность атомов с одинаковым зарядом ядра.Н11,007971s1Водород 312ИЗОТОПЫ+1H
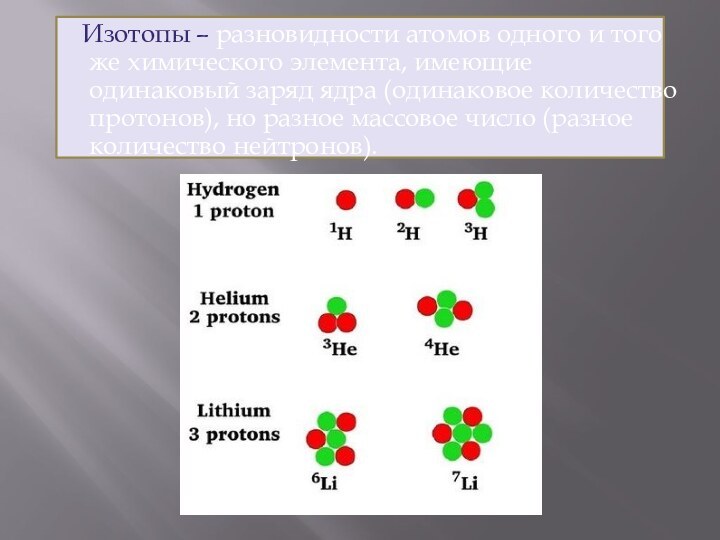
- 28. Изотопы – разновидности атомов одного и того
- 31. Скачать презентацию
- 32. Похожие презентации
Понятие атом возникло ещё в античном мире для обозначения частиц вещества.




















Слайд 4
Ученые древности о строении вещества
Древнегреческий ученый Демокрит 2500
лет назад считал, что любое вещество состоит из мельчайших
частиц, которые впоследствии были названы «атомами», что в переводе на русский язык означает «неделимый»Долгое время считалось, что атом является неделимой частицей.
Слайд 5
СТОНЕИ (Стони) Джордж Джонстон (Stoney George Johnstone) (15.II.1826
– 5.VII.1911) — ирландский физик и математик, член Ирландского
королевского об-ва (1861), его секретарь на протяжении 20 лет.Ирландский физик СТОНИ на основании опытов пришёл к выводу, что электричество переносится мельчайшими частицами, существующими в атомах всех химических элементов В 1891 предложил название «электрон», что по-гречески означает «янтарь» для элементарного
Слайд 7 Джозеф Томсон и Жан Перрен доказали, что электроны
несут на себе отрицательный заряд
Джозеф Томсон
Жан Перрен
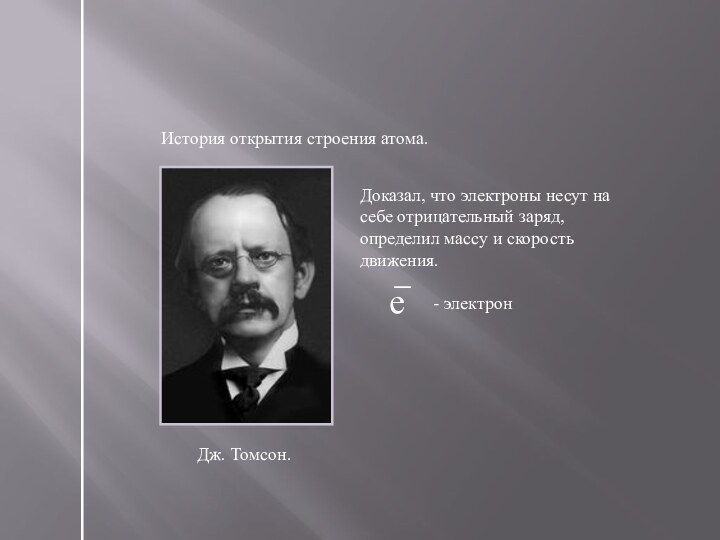
Слайд 8
История открытия строения атома.
Дж. Томсон.
Доказал, что электроны несут
на себе отрицательный заряд, определил массу и скорость движения.
е
-
электрон
Слайд 11
Эрнест Резерфорд
В 1910 г. Эрнест Резерфорд со своими
учениками и коллегами изучал рассеивание альфа-частиц, проходящих через тонкую
золотую фольгу и попадавших на экран.Слайд 12 Доказал, что атом имеет плотное ядро. Предложил планетарную
теорию строения атома.
Э. Резерфорд
Слайд 17
В 1911 г. английский ученый
Э. Резерфорд
доказал
,что в центре атома
имеется положительно
заряженное ядро.
Слайд 18
Планетарная модель строения атома
Резерфорд предположил, что
атом устроен подобно планетарной системе.
Суть модели строения атома
по Резерфорду заключается в следующем: в центре атома находится положительно заряженное ядро, в котором сосредоточена вся масса, вокруг ядра по круговым орбитам на больших расстояниях вращаются электроны (как планеты вокруг Солнца).Заряд ядра совпадает с номером химического элемента в таблице Менделеева.





























