их справедливость нужно было подтвердить или опровергнуть с помощью
эксперимента.Решающий вклад в создание современной теории строения атома внес английский физик Эрнест Резерфорд
Эрнест
Резерфорд
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть












Эрнест
Резерфорд
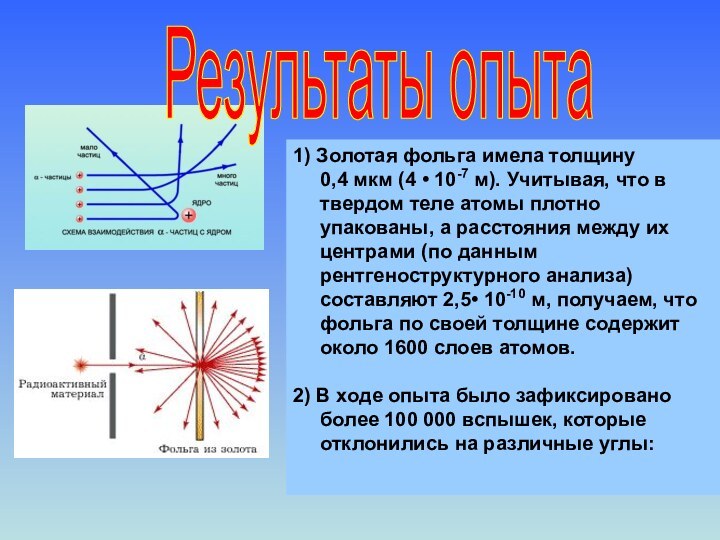
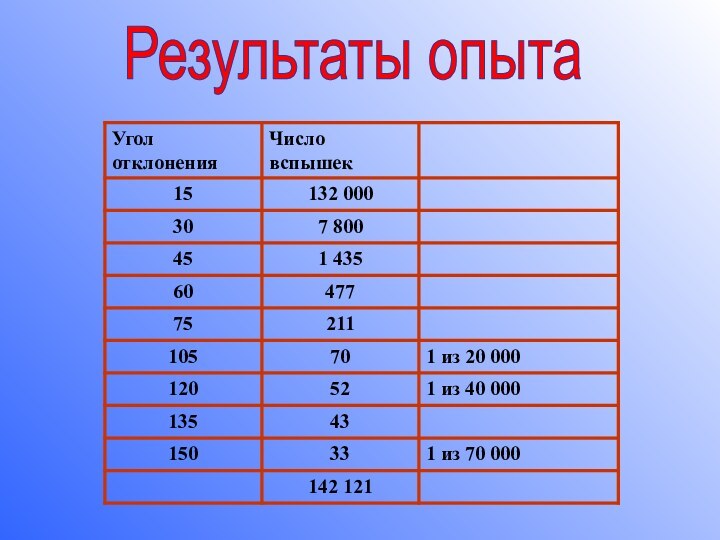
2) Если на пути α -частиц установить препятствие, в виде тонкой металлической фольги, то картина на экране изменялась.
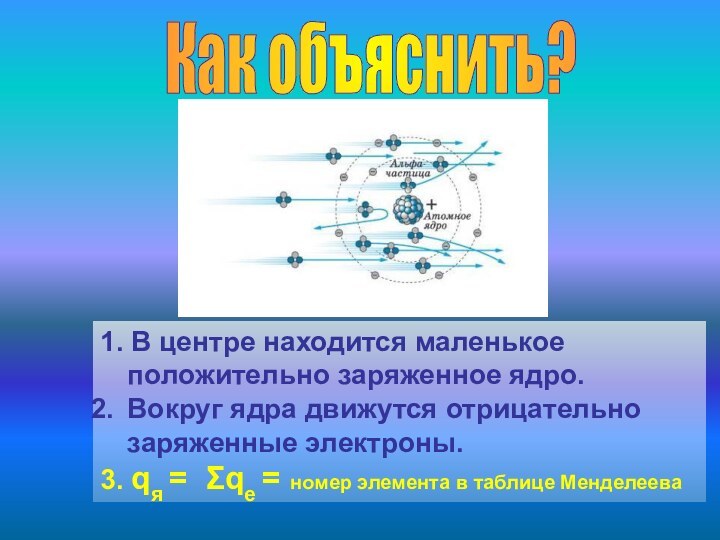
Атом должен прекратить своё существование!
К явлениям атомных масштабов законы классической физики неприменимы!
2. При переходе из одного состояния в другое атом излучает (поглощает) фотон.