Слайд 2
Электрохимические методы
Электрохимические методы анализа и исследования основаны на
изучении и использовании процессов, протекающих на поверхности электрода или
в приэлектродном слое.
Любой электрический параметр (потенциал, сила тока, сопротивление и др.), функционально связанный с концентрацией определяемого компонента и поддающийся правильному измерению, может служить аналитическим сигналом.
Слайд 3
Электрохимические методы
Различают прямые и косвенные методы:
В
прямых методах используют зависимость силы тока (потенциала и т.
д.) от концентрации определяемого компонента.
В косвенных методах силу тока (потенциал и т. д.) измеряют с целью нахождения конечной точки титрования определяемого компонента подходящим титрантом, т. е. используют зависимость измеряемого параметра от объема титранта.
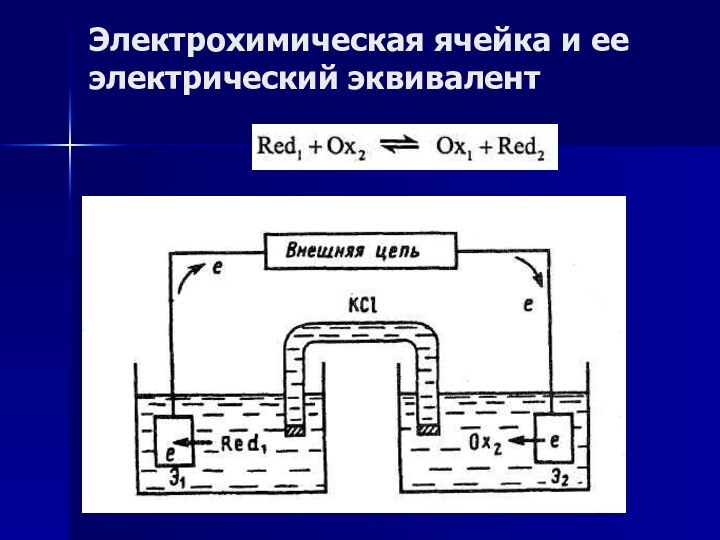
Для любого рода электрохимических измерений необходима электрохимическая цепь или электрохимическая ячейка, составной частью которой является анализируемый раствор.
Слайд 4
Электрохимическая ячейка и ее электрический эквивалент
Слайд 5
Ячейка для потенциометрических измерений
Слайд 6
Диффузионный потенциал или потенциал жидкостного соединения
Причиной его
возникновения является различие скоростей перемещения разных ионов через образовавшуюся
жидкостную границу, зависящее при фиксированной разности концентраций только от подвижностей ионов.
Слайд 7
солевой
мостик
Испытуемый раствор
Слайд 8
Индикаторный электрод
Один из электродов электрохимической ячейки должен обратимо
реагировать на изменение состава анализируемого раствора. Этот электрод, являющийся
как бы зондом, называют индикаторным.
Индикаторный электрод не должен реагировать с компонентами раствора, поэтому для их изготовления применяют химически инертные токопроводящие материалы: благородные металлы (золото, платина, ртуть), углеродные материалы (графит, стеклоуглерод).
Слайд 9
Электрод сравнения должен обладать постоянным и не зависящим
от состава раствора потенциалом. Иногда даже не обязательно знать
его числовую величину, лишь бы она воспроизводилась от опыта к опыту и не изменялась при протекании через ячейку небольших токов.
А также иметь:
- низкое электрическое сопротивление,
- отсутствие влияния на состав анализируемого раствора,
- способность не вызывать появления значительного диффузионного потенциала,
- простота конструкции.
Электрод сравнения
Слайд 10
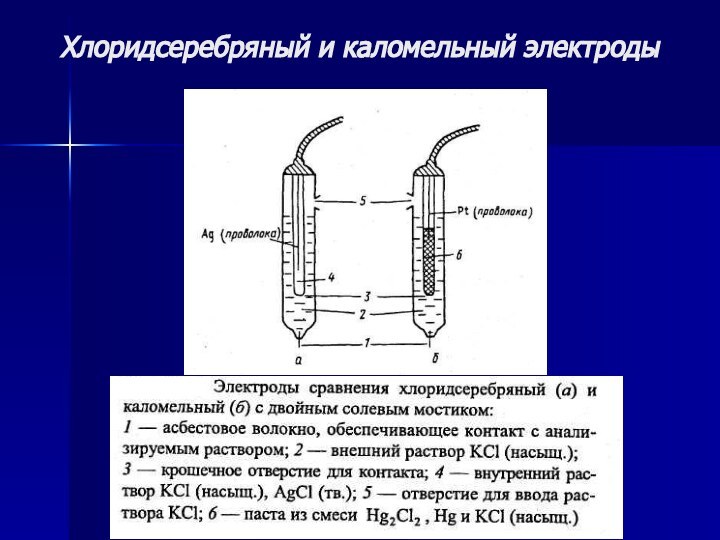
Хлоридсеребряный и каломельный электроды
Слайд 11
Насыщенный каломельный электрод
С разрешения Arthur H. Thomas
Company
Слайд 12
Хлоридсеребряный и каломельный электроды
ХСЭ
НКЭ
При 25 °С потенциал
ХСЭ равен 0,222 ± 0,002 В (относительно СВЭ).
При
25 °С потенциал 0,247 ± 0,001 В (относительно СВЭ).
Слайд 13
Схематическое представление пере-счета величины потенциала относитель-но различных электродов
сравнения
Слайд 14
Гальванический элемент и электролитическая ячейка
В электрохимической ячейке, рассмотренной
ранее, ток возникает в результате самопроиз-вольной химической реакции. Такие
ячейки называют гальваническими элементами.
Но если измерительное устройство заменить активным инструментом, например источником постоянного напряжения, то эта же ячейка станет потребителем внешней энергии и будет работать в режиме электролитической ячейки. В этом случае, регулируя внешнее наложенное напряжение, можно не только изменить направление реакции, но и контролировать глубину ее протекания.
Слайд 15
Равновесные электрохимические системы
В результате электрохимической реакции возникает
фарадеевский ток.
При равновесии электрохимическая реакция протекает в обоих
направлениях с одинаковыми скоростями, определяемыми плотностью тока обмена I0 (А∙см2), I0 = |Iк| = |Iа|. В этих условиях ток во внешней цепи не протекает и систему называют равновесной. Индикаторный электрод в условиях равновесия приобретает потенциал, называемый равновесным, Ер.
Слайд 16
Равновесные электрохимические системы
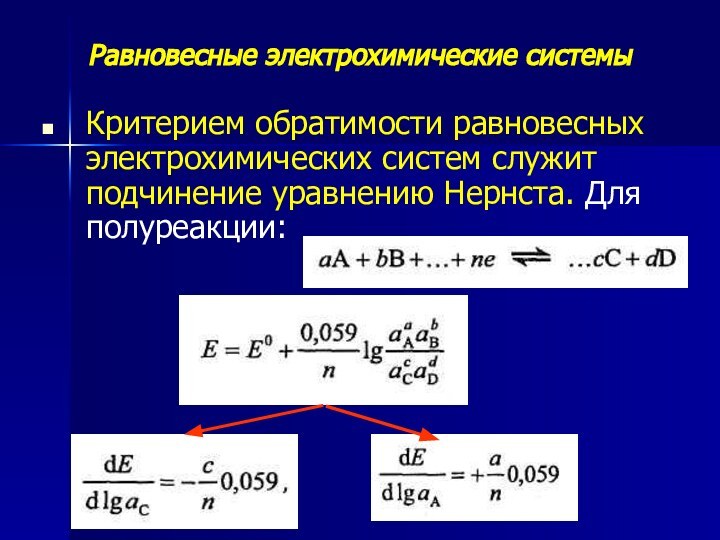
Критерием обратимости равновесных электрохимических систем служит
подчинение уравнению Нернста. Для полуреакции:
Слайд 17
Равновесные обратимые электрохимические системы
Если эти уравнения выполняются для
всех участников полуреакции, то окислительно-восстановительную систему называют обратимой или
нернстовской :
Слайд 18
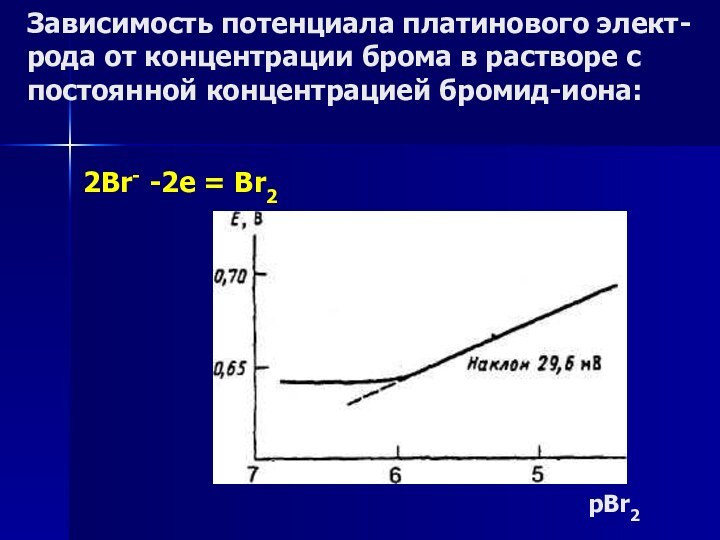
Зависимость потенциала платинового элект-рода от концентрации брома в
растворе с постоянной концентрацией бромид-иона:
pBr2
2Br- -2e = Br2
Слайд 19
Необратимые электрохимические системы
Известен, однако, ряд окилительно-восстановительных систем, не
подчиняющихся уравнению Нернста ни при каких концентрациях. Такие системы
принято называть необратимыми:
Слайд 21
Потенциометрия
.
В основе потенциометрических измерений лежит зависимость равновесного
потенциала электрода от активности (концентрации) определяемого иона.
Для измерений
необходимо составить гальванический элемент из подходящего индикаторного электрода и электрода сравнения, а также иметь прибор для измерения потенциала индикаторного электрода в условиях, близких к термодинамическим.
Слайд 22
Индикаторные электроды
В потенциометрии применяют:
мембранные (ионселективные) и
металлические индикаторные
электроды.
Слайд 23
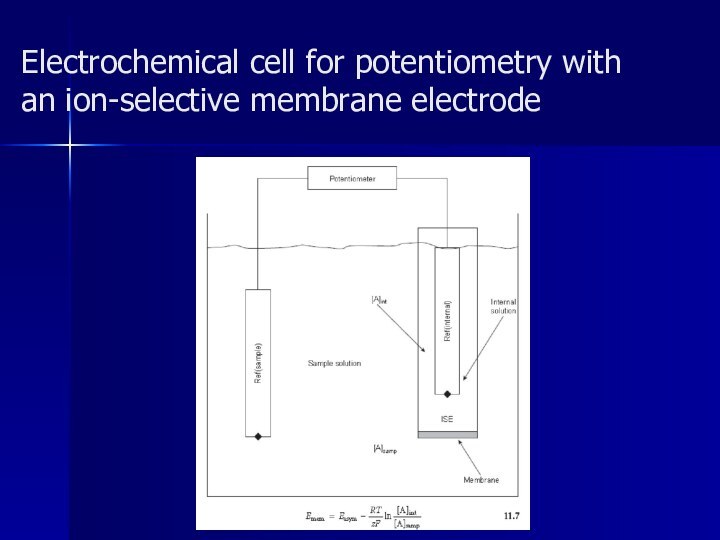
Мембранные электроды
По определению ИЮПАК, «ионселективные электроды — это
сенсоры (чувствительные элементы, датчики), потенциалы которых линейно зависят от
lga определяемого иона в растворе».
Полупроницаемая мембрана — тонкая пленка, отделяющая внутреннюю часть электрода (внутренний раствор) от анализируемого и обладающая способностью пропускать ионы только одного вида (катионы или анионы).
Слайд 24
Мембранный потенциал Ем
М
+
+
+
+
+
+
+
а1 – анализируемый раствор
а2
– внутренний раствор
Е1
Е2
Активность ионов А+ во внутреннем растворе постоянна,
поэтому:
Слайд 25
Electrochemical cell for potentiometry with
an ion-selective membrane electrode
Слайд 26
Селективность мембранного электрода
Любая мембрана в той или иной
мере проницаема для всех ионов одного вида, находящихся в
растворе, и поэтому необходимо учитывать влияние посторонних ионов, например В+, на потенциал электрода. Ионы В+ проникают в фазу мембраны в результате реакции обмена:
Слайд 27
Селективность мембранного электрода
Потенциал мембранного электрода в растворе, содержащем
кроме определяемого иона А посторонние ионы В, С и
другие, описывается модифицированным уравнением Нернста (уравнением Никольского):
где zA — целое число, по знаку и величине равное заряду иона А (зарядовое число); zB, zc — то же, для ионов В и С; k пот — потенциометрический коэффициент селективности; const включает значения потенциалов внешнего и внутреннего электродов сравнения и зависит от природы мембраны.