- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Поверхностные явления
Содержание
- 2. Поверхностное натяжениеФизический смысл поверхностного натяжениярМ – внутримолекулярное давление
- 3. Энергетическое определение поверхностного натяженияПоверхностное натяжение (σ) –
- 4. Термодинамическое определение поверхностного натяжения Поверхностное натяжение - частная
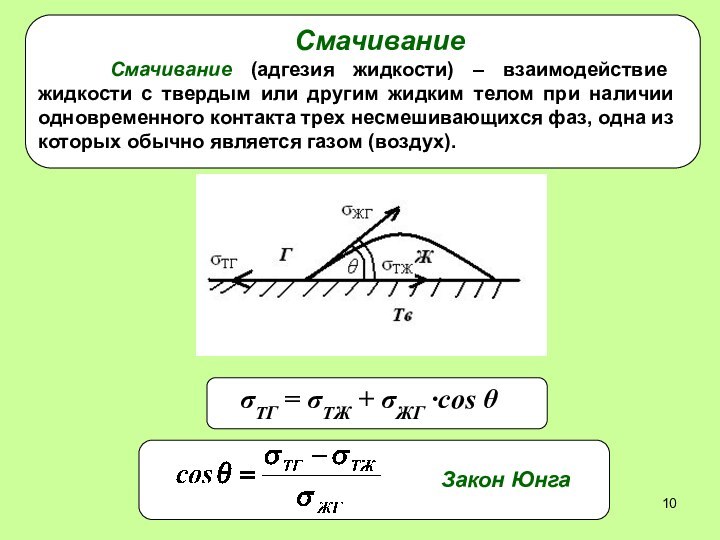
- 5. Влияние различных факторов на величину поверхностного натяженияХимическая природа вещества * - представлены величины удельной поверхностной энергии
- 6. Природа граничащих фаз Поверхностное натяжение на границе двух жидкостей зависит от полярности.
- 7. Межмолекулярные и межфазные взаимодействия
- 8. Адгезия Адгезия – взаимодействие
- 9. Растекание жидкости
- 10. Смачивание Смачивание (адгезия жидкости) – взаимодействие жидкости с
- 11. Анализ уравнения Юнга
- 12. Анализ уравнения Юнга
- 13. Правило: лучше смачивает поверхность та жидкость, которая ближе по полярности к смачиваемому материалу.
- 14. Флотация
- 15. Пример. Порошок кварца и серы высыпали на
- 16. Капиллярные явлениякапиллярное поднятие (опускание) жидкости;капиллярная конденсация;изотермическая перегонка.
- 17. Капиллярное поднятие (опускание) жидкости
- 19. Высоту капиллярного поднятия жидкости можно вычислить1.
- 20. Капиллярным поднятием жидкостей объясняется ряд известных процессов
- 21. Влияние кривизны поверхности на давление насыщенного пара
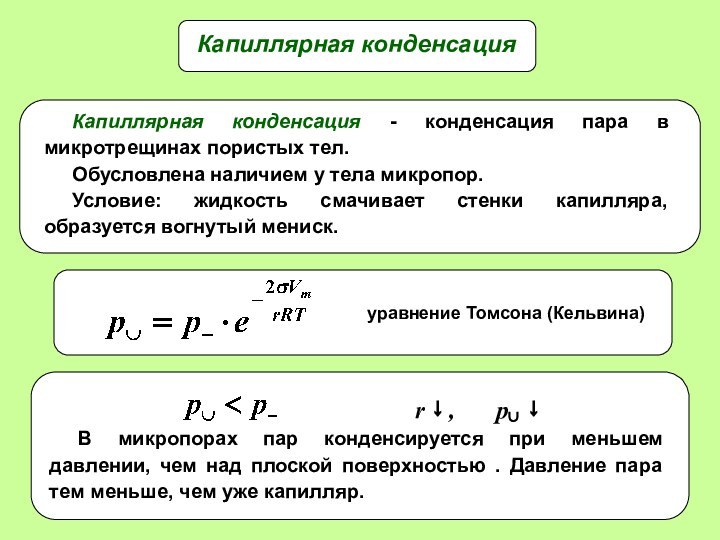
- 22. Капиллярная конденсация
- 23. Изотермическая перегонка
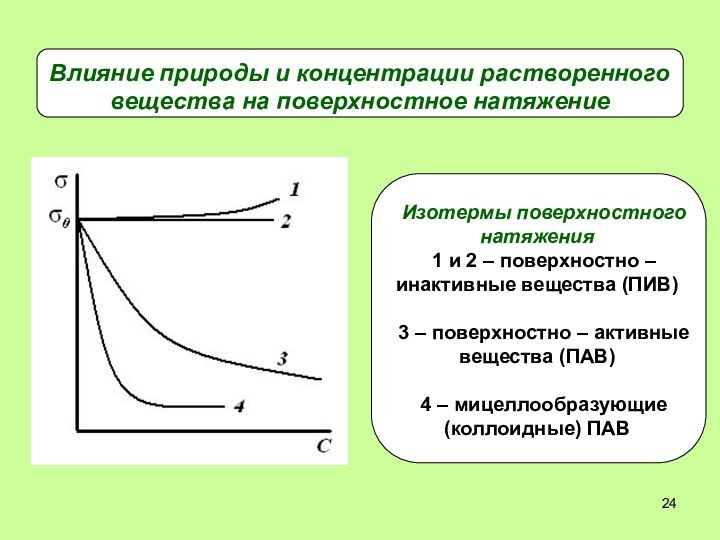
- 24. Влияние природы и концентрации растворенного вещества на поверхностное натяжение
- 25. Свойства ПАВ и ПИВ
- 26. Ориентация молекул ПАВ в поверхностном слое
- 27. Мицеллообразующие ПАВ Молекулы коллоидных ПАВ состоят из
- 28. Прямые мицеллы - мицеллы ПАВ, образуются в
- 29. Мицеллы коллоидных ПАВ: а – сферические; б – дискообразные; в – цилиндрические.
- 30. Солюбилизация
- 31. Скачать презентацию
- 32. Похожие презентации
Поверхностное натяжениеФизический смысл поверхностного натяжениярМ – внутримолекулярное давление


























Слайд 2
Поверхностное натяжение
Физический смысл поверхностного натяжения
рМ – внутримолекулярное давление
Слайд 4
Термодинамическое определение поверхностного натяжения
Поверхностное натяжение - частная производная
от любого термодинамического потенциала по площади межфазной поверхности при
постоянных соответствующих параметрах.Единицы измерения
Энергетическая – Дж/м2, силовая – Н/м.
Для воды при 293 К:
СИ: Дж/м2 = Н∙м/м2 =Н/м
Слайд 5
Влияние различных факторов на величину поверхностного натяжения
Химическая природа
вещества
* - представлены величины удельной поверхностной энергии
Слайд 6
Природа граничащих фаз
Поверхностное натяжение на границе двух жидкостей
зависит от полярности.
Слайд 8
Адгезия
Адгезия – взаимодействие между
разнородными конденсированными телами при их молекулярном контакте.
Причина адгезии – молекулярное притяжение контактирующих веществ или их химическое взаимодействие.
Слайд 10
Смачивание
Смачивание (адгезия жидкости) – взаимодействие жидкости с твердым
или другим жидким телом при наличии одновременного контакта трех
несмешивающихся фаз, одна из которых обычно является газом (воздух).Слайд 13 Правило: лучше смачивает поверхность та жидкость, которая ближе
по полярности к смачиваемому материалу.
Слайд 15 Пример. Порошок кварца и серы высыпали на поверхность
воды. Какое явление можно ожидать, если краевой угол смачивания
для кварца 0°, а для серы 78°.
Слайд 16
Капиллярные явления
капиллярное поднятие (опускание) жидкости;
капиллярная конденсация;
изотермическая перегонка.
Слайд 19
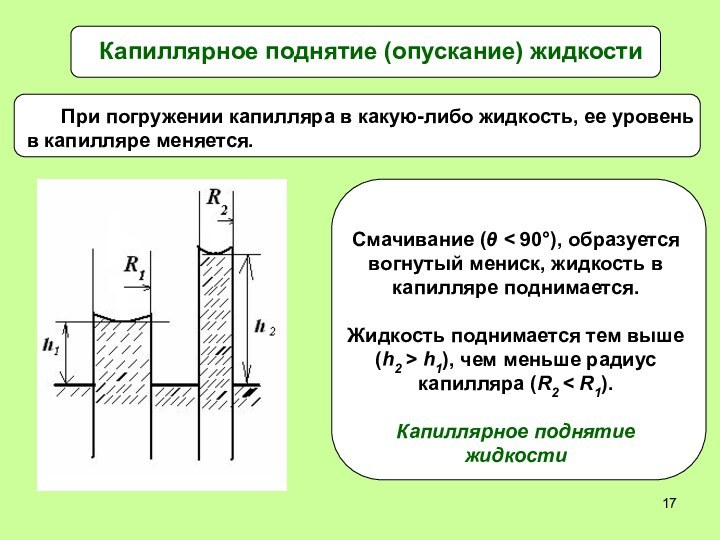
Высоту капиллярного поднятия жидкости можно вычислить
1. Смачивание:
cos θ > 0, h > 0, жидкость в
капилляре поднимается. Чем меньше R, тем больше h – высота поднятия.2. Несмачивание: cos θ < 0, h < 0, жидкость в капилляре опускается. Чем меньше R, тем ниже опускается жидкость в капилляре.
Слайд 20 Капиллярным поднятием жидкостей объясняется ряд известных процессов и
явлений:
поднятие грунтовых вод в почвах обеспечивает существование растительного
покрова Земли;пропитка бумаги и тканей – поднятие жидкости в порах;
водонепроницаемость тканей – ткани пропитывают веществами, которые вода не смачивает – капиллярная депрессия;
питание растений (деревьев) – подъем воды из почвы по волокнам древесины;
процессы кровообращения в кровеносных сосудах.
Слайд 27
Мицеллообразующие ПАВ
Молекулы коллоидных ПАВ состоят из большого
гидрофобного углеводород-ного радикала и сильно гидратиру-ющейся полярной группы (кривая
4).Например:
стеариновая кислота С17Н35СООН, пальмитиновая кислота С15Н31СООН, олеиновая кислота С17Н33СООН.