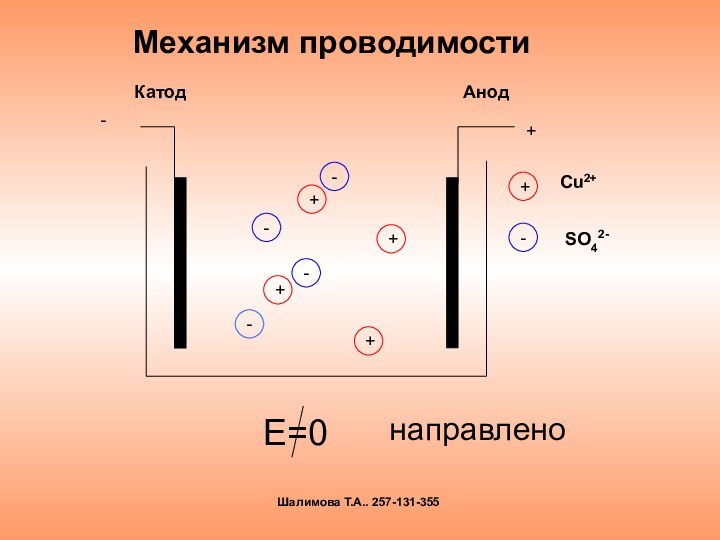
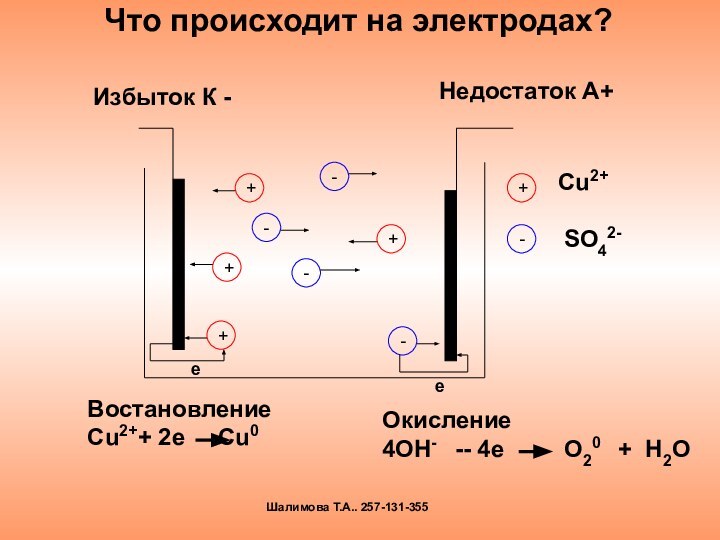
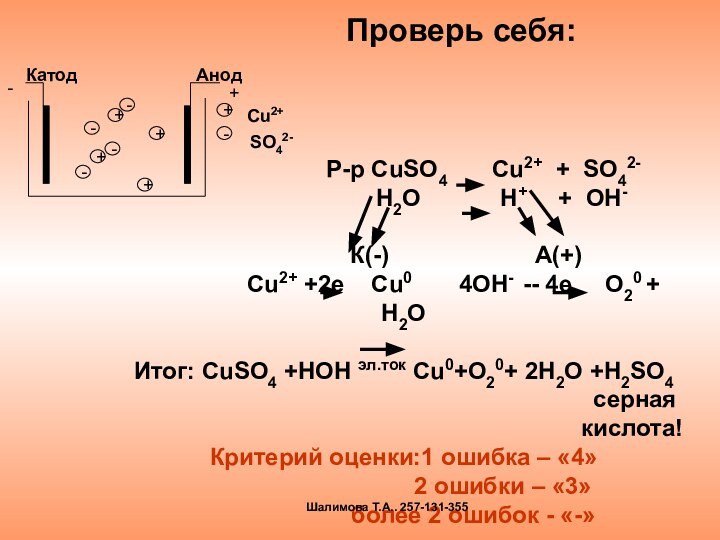
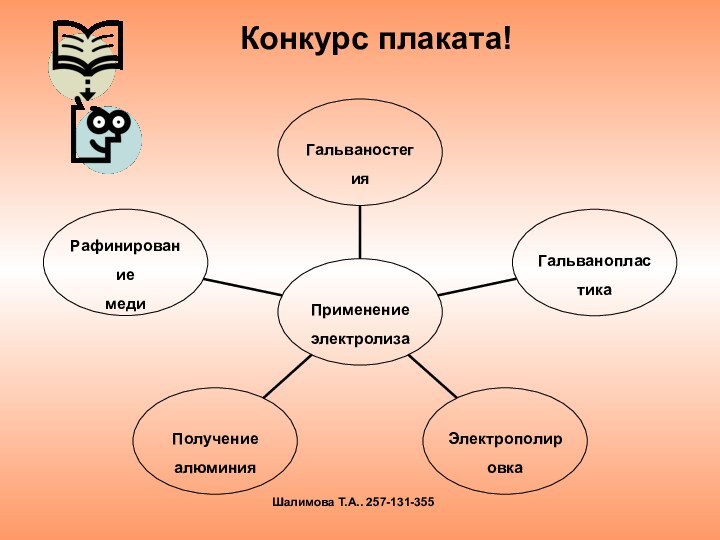
электролиза и его практическим
применением
- знать основные понятия по
теме и законы электролизауметь работать в группе, вести диалог, быть терпимым
к другому мнению
- использовать разные источники информации
овладевать исследовательскими навыками, навыками
самооценки
Шалимова Т.А.. 257-131-355