Слайд 2
Содержание
Сущность электролиза
Практическое применение электролиза
Слайд 3
Сущность электролиза
Электролиз — это окислительно-восстановительный процесс, протекающий
на электродах при прохождении постоянного электрического тока через раствор
или расплав электролитов.
Для осуществления электролиза к отрицательному полюсу внешнего источника постоянного тока присоединяют катод, а к положительному полюсу — анод, после чего погружают их в электролизер с раствором или расплавом электролита.
Электроды, как правило, бывают металлические, но применяются и неметаллические, например графитовые (проводящие ток).
Слайд 4
В результате электролиза на электродах (катоде и
аноде) выделяются соответствующие продукты восстановления и окисления, которые в
зависимости от условий могут вступать в реакции с растворителем, материалом электрода и т. п., — так называемые вторичные процессы.
Металлические аноды могут быть: а) нерастворимыми или инертными (Pt, Au, Ir, графит или уголь и др.), при электролизе они служат лишь передатчиками электронов; б) растворимыми (активными); при электролизе они окисляются.
Слайд 5
В растворах и расплавах различных электролитов имеются разноименные
по знаку ионы, т. е. катионы и анионы, которые
находятся в хаотическом движении. Но если в такой расплав электролита, например расплав хлорида натрия NaCl, опустить электроды и пропускать постоянный электрический ток, то катионы Na+ будут двигаться к катоду, а анионы Cl– — к аноду. На катоде электролизера происходит процесс восстановления катионов Na+ электронами внешнего источника тока:
Na+ + e– = Na0
Слайд 6
На аноде идет процесс окисления анионов хлора, причем
отрыв избыточных электронов от Cl– осуществляется за счет энергии
внешнего источника тока:
Cl– – e– = Cl0
Выделяющиеся электронейтральные атомы хлора соединяются между собой, образуя молекулярный хлор: Cl + Cl = Cl2, который и выделяется на аноде.
Суммарное уравнение электролиза расплава хлорида натрия:
2NaCl —> 2Na+ + 2Cl– —электролиз—> 2Na0 + Cl20
Слайд 7
Окислительно-восстановительное действие электрического тока может быть во много
раз сильнее действия химических окислителей и восстановителей. Меняя напряжение
на электродах, можно создать почти любой силы окислители и восстановители, которыми являются электроды электролитической ванны или электролизера.
Слайд 8
Известно, что ни один самый сильный химический
окислитель не может отнять у фторид-Иона F– его электрон.
Но это осуществимо при электролизе, например, расплава соли NaF. В этом случае на катоде (восстановитель) выделяется из ионного состояния металлический натрий или кальций:
Na+ + e– = Na0
на аноде (окислитель) выделяется ион фтора F–, переходя из отрицательного иона в свободное состояние:
F– – e– = F0 ; F0 + F0 = F2
Слайд 9
Продукты, выделяющиеся на электродах, могут вступать между собой
в химическое взаимодействие, поэтому анодное и катодное пространство разделяют
диафрагмой.
Слайд 10
Практическое применение электролиза
Электрохимические процессы широко применяются в различных
областях современной техники, в аналитической химии, биохимии и т.
д. В химической промышленности электролизом получают хлор и фтор, щелочи, хлораты и перхлораты, надсерную кислоту и персульфаты, химически чистые водород и кислород и т. д. При этом одни вещества получают путем восстановления на катоде (альдегиды, парааминофенол и др.), другие электроокислением на аноде (хлораты, перхлораты, перманганат калия и др.).
Слайд 11
Электролиз в гидрометаллургии является одной из стадий
переработки металлсодержащего сырья, обеспечивающей получение товарных металлов.
Электролиз может осуществляться
с растворимыми анодами - процесс электрорафинирования или с нерастворимыми - процесс электроэкстракции.
Главной задачей при электрорафинировании металлов является обеспечения необходимой чистоты катодного металла при приемлемых энергетических расходах.
Слайд 12
В цветной металлургии электролиз используется для извлечения
металлов из руд и их очистки. Электролизом расплавленных сред
получают алюминий, магний, титан, цирконий, уран, бериллий и др.
Для рафинирования (очистки) металла электролизом из него отливают пластины и помещают их в качестве анодов в электролизер. При пропускании тока металл, подлежащий очистке, подвергается анодному растворению, т. е. переходит в раствор в виде катионов. Затем эти катионы металла разряжаются на катоде, благодаря чему образуется компактный осадок уже чистого металла. Примеси, находящиеся в аноде, либо остаются нерастворимыми, либо переходят в электролит и удаляются.
Слайд 13
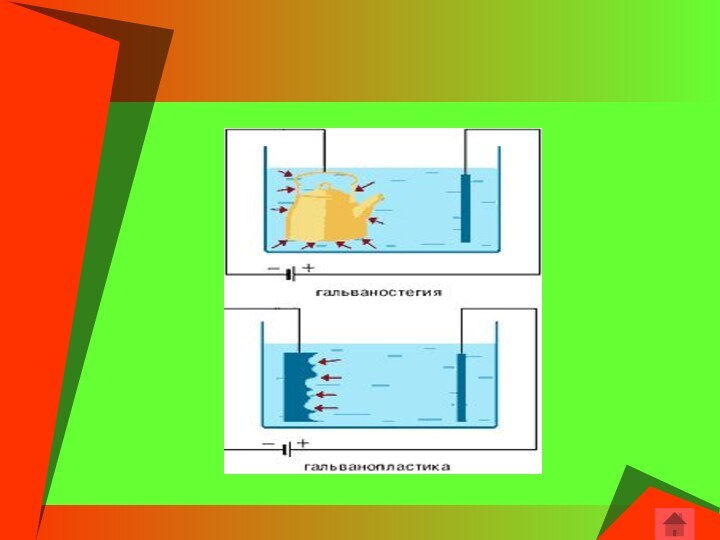
Гальванотехника – область прикладной электрохимии, занимающаяся процессами
нанесения металлических покрытий на поверхность как металлических, так и
неметаллических изделий при прохождении постоянного электрического тока через растворы их солей. Гальванотехника подразделяется на гальваностегию и гальванопластику.
Слайд 14
Гальваностегия (от греч. покрывать) – это электроосаждение на
поверхность металла другого металла, который прочно связывается (сцепляется) с
покрываемым металлом (предметом), служащим катодом электролизера.
Перед покрытием изделия необходимо его поверхность тщательно очистить (обезжирить и протравить), в противном случае металл будет осаждаться неравномерно, а кроме того, сцепление (связь) металла покрытия с поверхностью изделия будет непрочной. Способом гальваностегии можно покрыть деталь тонким слоем золота или серебра, хрома или никеля. С помощью электролиза можно наносить тончайшие металлические покрытия на различных металлических поверхностях. При таком способе нанесения покрытий, деталь используют в качестве катода, помещенного в раствор соли того металла, покрытие из которого необходимо получить. В качестве анода используется пластинка из того же металла.
Слайд 15
Гальванопластика – получение путем электролиза точных, легко отделяемых
металлических копий относительно значительной толщины с различных как неметаллических,
так и металлических предметов, называемых матрицами.
С помощью гальванопластики изготовляют бюсты, статуи и т. д.
Гальванопластика используется для нанесения сравнительно толстых металлических покрытий на другие металлы (например, образование "накладного" слоя никеля, серебра, золота и т. д.).