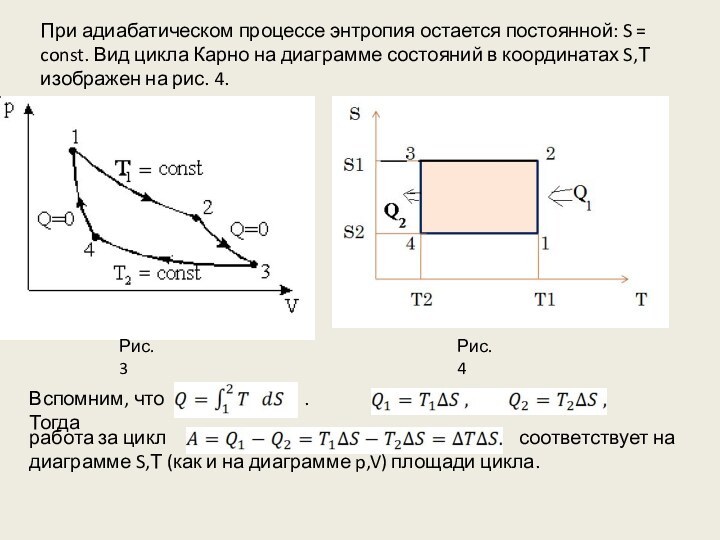
теплоты , переданного системе при любом
элементарном процессе, к температуре при которой этот процесс произошел, называется приведенным количеством теплоты:Свойства приведенного количества теплоты, полученные опытным путем:
Для произвольного обратимого процесса 1-2 приведенное количество теплоты , сообщаемое системе
не зависит от характера процесса, а для кругового процесса эта величина равна нулю:
Отсюда следует, что в случае обратимого процесса величина является полным дифференциалом некоторой функции S ,которая является функцией состояния системы:
(1)