- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии Типы химической связи
Содержание
- 2. ПонятияХимическая связь – это такое взаимодействие атомов,
- 3. Ковалентная связьэто связь, возникающая между атомами за
- 4. Ковалентная химическая связь
- 5. Ковалентная неполярная связьКНС образуют атомы одного и
- 6. FFОсь симметрииF+91s2s2p225271s2s2pF+91s2s2p225271s2s2p3.983.98
- 7. OOОсь симметрииO+81s2s2p224261s2s2pO+81s2s2p224261s2s2p3.503.50
- 8. NNОсь симметрииN+71s2s2p223251s2s2pN+71s2s2p223251s2s2p3.073.07
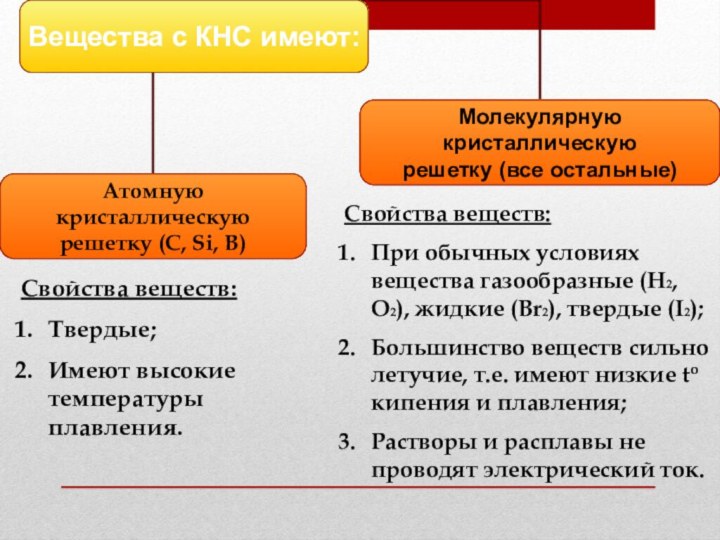
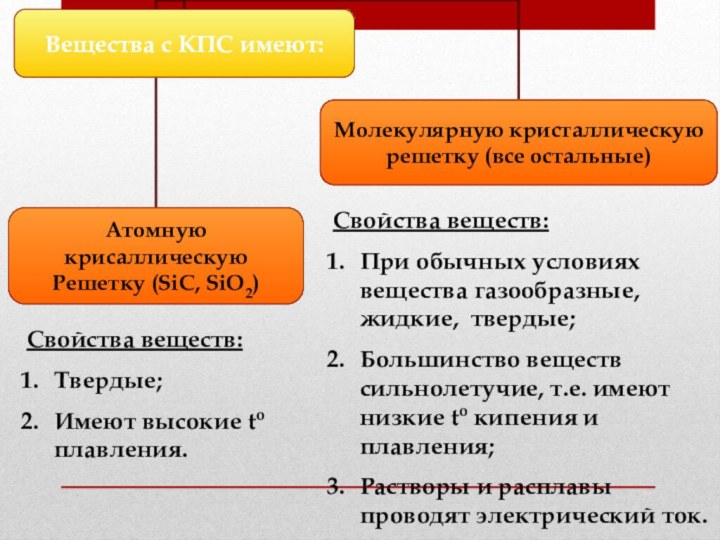
- 10. Свойства веществ:Твердые;Имеют высокие температуры плавления.Свойства веществ:При обычных
- 11. Ковалентная полярная связьКПС образуют атомы разных неметаллов
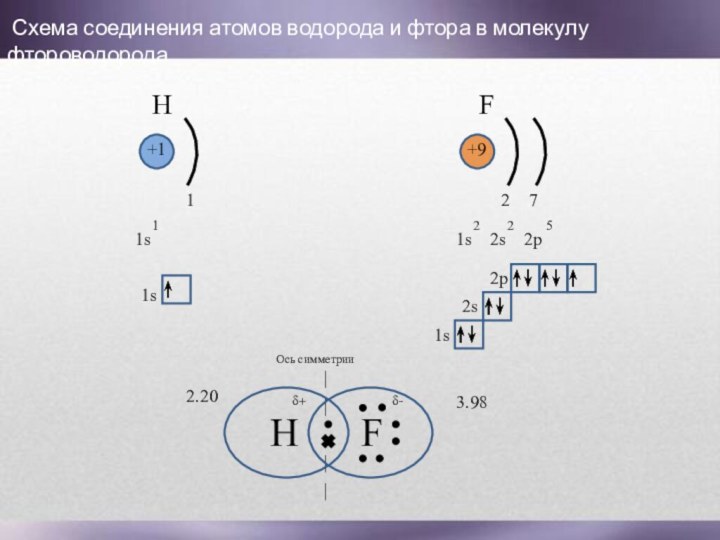
- 12. HF1s11+1+91s2s2p225271s1s2s2pHFОсь симметрии2.203.98 Схема соединения атомов водорода и фтора в молекулу фтороводородаδ+δ-
- 14. Свойства веществ:При обычных условиях вещества газообразные, жидкие,
- 15. Ионная связьэто связь, образовавшаяся за счет
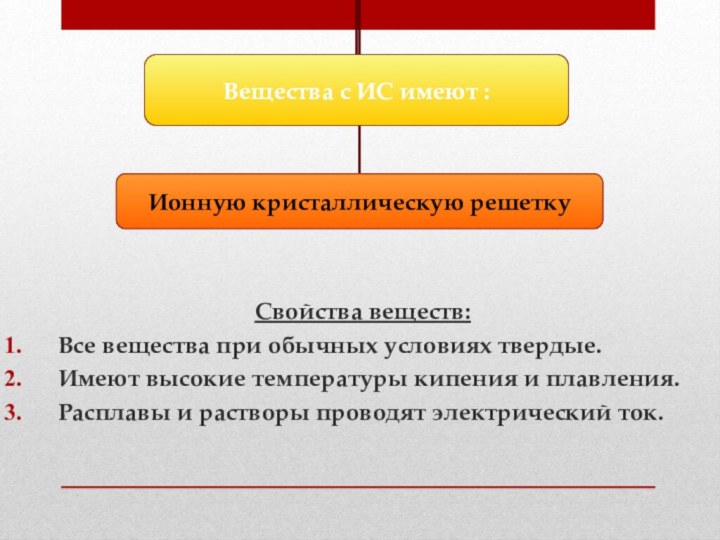
- 16. Свойства веществ:Все вещества при обычных условиях твердые.Имеют
- 17. Водородная связьХимическая связь между положительно поляризованными атомами
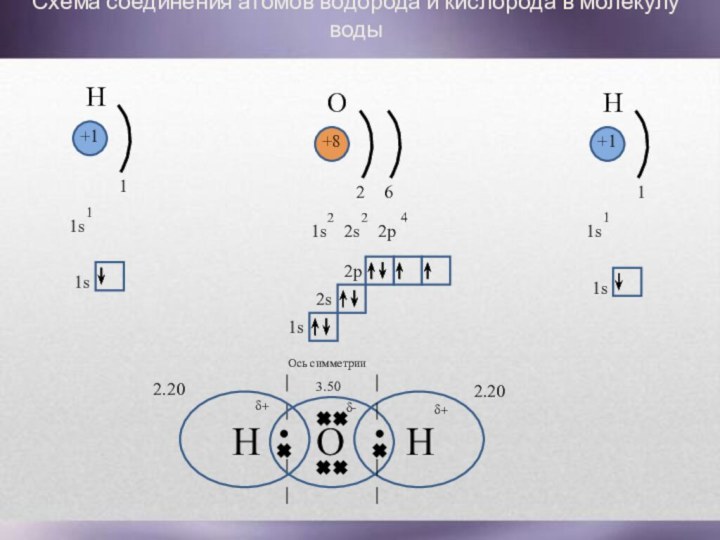
- 18. H1s11+11sHН2.20+81s2s2p224261s2s2pО1s11+11sHООсь симметрии3.502.20Схема соединения атомов водорода и кислорода в молекулу водыδ-δ+δ+
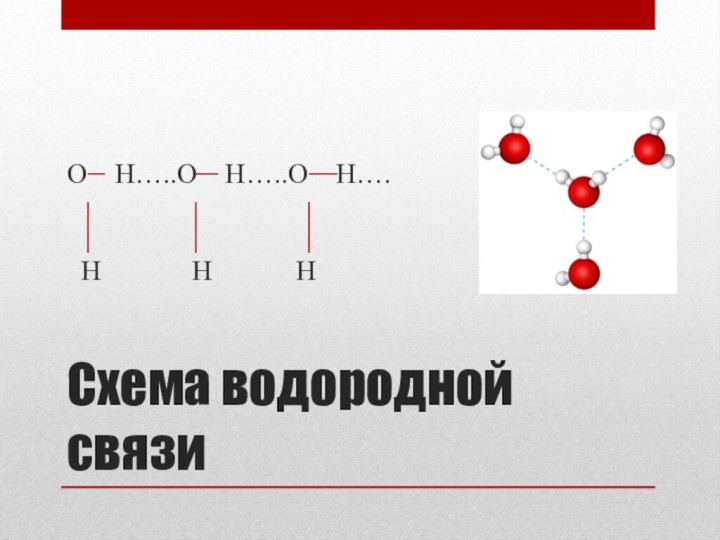
- 19. O H…..O H…..O H….
- 20. Металлическая связьсвязь в металлах и сплавах, которую
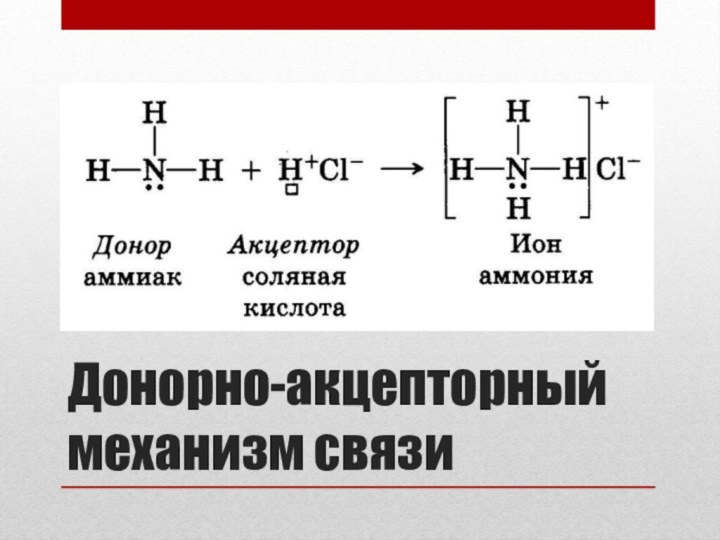
- 21. Донорно-акцепторный механизм связи
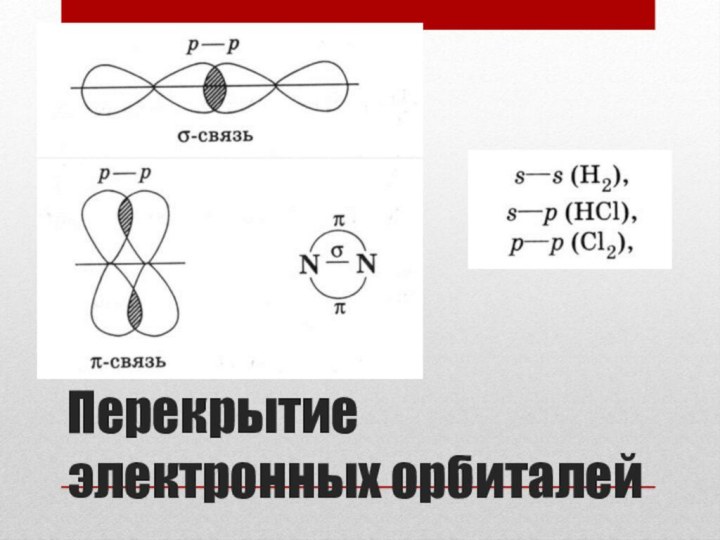
- 22. Перекрытие электронных орбиталей
- 23. А-1 В
- 24. А-2. Термин «молекула»
- 25. А-3 Какая химическая связь
- 26. А-4 Различие в
- 27. А-5 В веществе CH3 –
- 28. В-1 Установите соответствие между
- 29. В-2 Установите соответствие между формулой
- 30. Скачать презентацию
- 31. Похожие презентации
ПонятияХимическая связь – это такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.Различают четыре типа химических связей: ионную, ковалентную, металлическую и водородную.



















Слайд 2
Понятия
Химическая связь – это такое взаимодействие атомов, которое
связывает их в молекулы, ионы, радикалы, кристаллы.
химических связей: ионную, ковалентную, металлическую и водородную.
Слайд 3
Ковалентная связь
это связь, возникающая между атомами за счет
образования общих электронных пар.
По степени смещенности общих электронных пар
к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
Слайд 5
Ковалентная неполярная связь
КНС образуют атомы одного и того
же химического элемента.
Механизм образования связи.
Каждый
атом неметалла отдает в общее пользование другому атому наружные неспаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.Примеры образования КНС:
Слайд 6
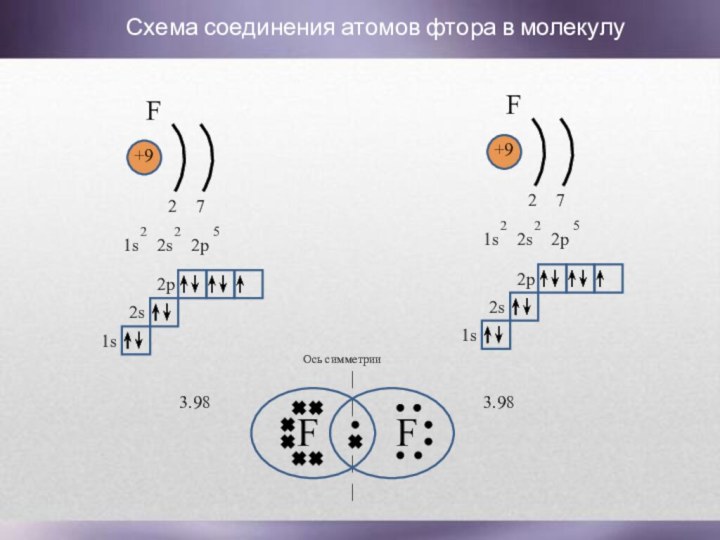
F
F
Ось симметрии
F
+9
1s
2s
2p
2
2
5
2
7
1s
2s
2p
F
+9
1s
2s
2p
2
2
5
2
7
1s
2s
2p
3.98
3.98
Схема соединения атомов фтора в
молекулу
Слайд 7
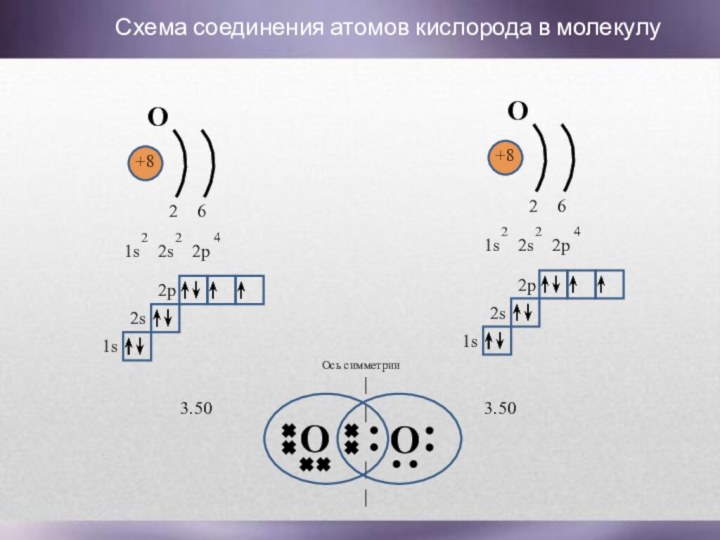
O
O
Ось симметрии
O
+8
1s
2s
2p
2
2
4
2
6
1s
2s
2p
O
+8
1s
2s
2p
2
2
4
2
6
1s
2s
2p
3.50
3.50
Схема соединения атомов кислорода в молекулу
Слайд 8
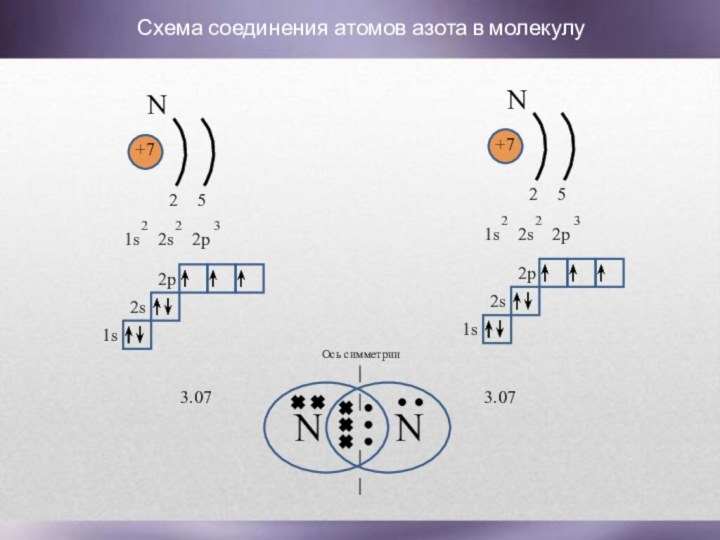
N
N
Ось симметрии
N
+7
1s
2s
2p
2
2
3
2
5
1s
2s
2p
N
+7
1s
2s
2p
2
2
3
2
5
1s
2s
2p
3.07
3.07
Схема соединения атомов азота
в молекулу
Слайд 10
Свойства веществ:
Твердые;
Имеют высокие температуры плавления.
Свойства веществ:
При обычных условиях
вещества газообразные (H2, O2), жидкие (Br2), твердые (I2);
Большинство веществ
сильно летучие, т.е. имеют низкие to кипения и плавления;Растворы и расплавы не проводят электрический ток.
Слайд 11
Ковалентная полярная связь
КПС образуют атомы разных неметаллов (с
разной электороотрицательностью). Электроотрицательность (ЭО)- это свойство атомов одного элемента
притягивать к себе электроны от атомов других элементов.Самый электроотрицательный элемент – F.
Механизм образования связи.
Каждый атом неметалла отдает в общее пользование другому атому свои наружные неспаренные электроны. Образуются общие электронные пары. Общая электронная пара смещена к более электроотрицательному элементу.
Примеры образования связи.
Слайд 12
H
F
1s
1
1
+1
+9
1s
2s
2p
2
2
5
2
7
1s
1s
2s
2p
H
F
Ось симметрии
2.20
3.98
Схема соединения атомов водорода и фтора
в молекулу фтороводорода
δ+
δ-
Слайд 14
Свойства веществ:
При обычных условиях вещества газообразные, жидкие, твердые;
Большинство
веществ сильнолетучие, т.е. имеют низкие to кипения и плавления;
Растворы
и расплавы проводят электрический ток.Свойства веществ:
Твердые;
Имеют высокие to плавления.
Слайд 15
Ионная связь
это связь, образовавшаяся за счет
электростатического притяжения
катионов к анионам
Слайд 16
Свойства веществ:
Все вещества при обычных условиях твердые.
Имеют высокие
температуры кипения и плавления.
Расплавы и растворы проводят электрический ток.
Слайд 17
Водородная связь
Химическая связь между положительно поляризованными атомами водорода
одной молекулы (или ее части) и отрицательно поляризованными атомами
сильно электроотрицательных элементов, имеющих неподеленные электронные пары (F, О, N и реже С1 и S) другой молекулы (или ее части)
Слайд 18
H
1s
1
1
+1
1s
H
Н
2.20
+8
1s
2s
2p
2
2
4
2
6
1s
2s
2p
О
1s
1
1
+1
1s
H
О
Ось симметрии
3.50
2.20
Схема соединения атомов водорода и кислорода в
молекулу воды
δ-
δ+
δ+
Слайд 20
Металлическая связь
связь в металлах и сплавах, которую выполняют
относительно свободные электроны между ионами металлов в металлической кристаллической
решетке о п+
М — пе М
Слайд 23 А-1 В каком
ряду написаны вещества только с ковалентной полярной связью?
а) хлор, аммиак, хлороводородб) бромоводород, оксид азота (+2), бром
в) сероводород, вода, сера
г) иодоводород, вода, аммиак
Тест
Слайд 24 А-2. Термин «молекула» нельзя
употреблять при характеристике строения
1) сероводорода2) азотной кислоты
3) озона
4) фторида кальция
Слайд 25 А-3 Какая химическая связь образуется
между атомами элементов с порядковыми номерами 9 и 19?
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
Слайд 26 А-4 Различие в значении
температур плавления CO2 (- 56,6) и SiO2 (+ 1728)
объясняется
1) различием в строении атомов углерода и кремния
2) различием в значениях масс молекул
3) разным видом химической связи
4) разным типом кристаллической решётки
Слайд 27 А-5 В веществе CH3 – CH3
связь между атомами углерода
1) ковалентная неполярная2) ковалентная полярная
3) ионная
4) водородная
2
Слайд 28 В-1 Установите соответствие между формулой
вещества и видом химической связи
Формула вещества
Вид химическойсвязи
А) I2 1) КПС
Б) ZnSO4 2) КНС
В) К2S 3) ИС, КПС
Г) Н2О 4) ВС
5) ИС
6) КНС, КПС
Слайд 29 В-2 Установите соответствие между формулой вещества
и видом химической связи
Формула вещества
Вид химическойсвязи
А) I2 1) КПС
Б) ZnSO4 2) КНС
В) К2S 3) ИС, КПС
Г) Н2О 4) ВС
5) ИС
6) КНС, КПС