- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Механизмы ограничения реакций
Содержание
- 2. Лучше знать лишнее,
- 3. Механизмом органической реакции называется совокупность
- 4. Для доказательства
- 5. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙРазнообразные органические
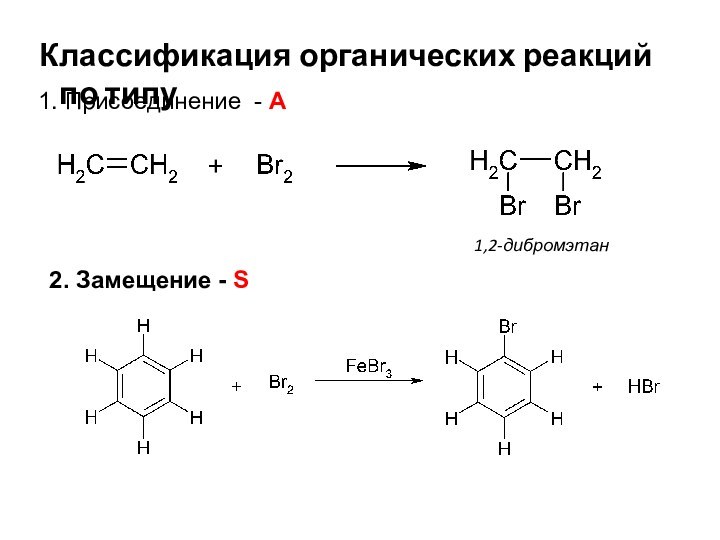
- 6. Классификация органических реакций
- 7. Классификация органических реакций по типу1. Присоединение - А 1,2-дибромэтан2. Замещение - S
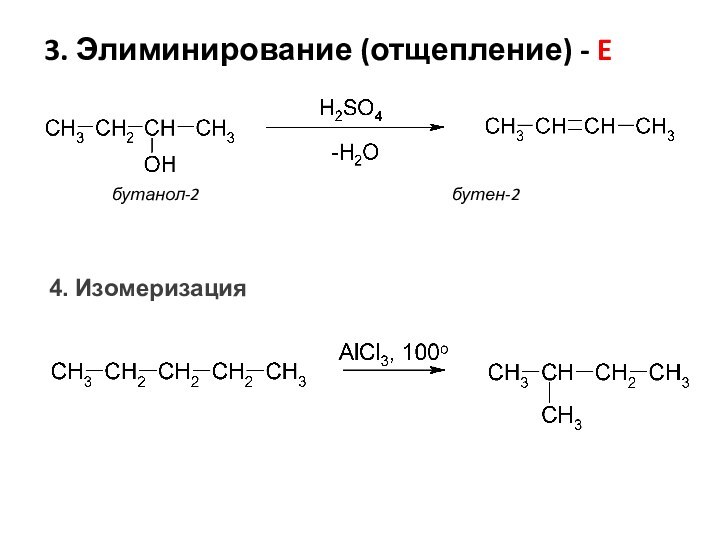
- 8. 3. Элиминирование (отщепление) - Eбутанол-2
- 9. 5. Окислительно-восстановительные реакции (ОВР) Окисление – процесс
- 10. В зависимости от способа разрыва связей в
- 12. А. Если при разрыве химической связи
- 13. Б. Если при разрыве связи пара
- 14. Нуклеофильными (любящими, ищущими ядра) называют реагенты, которые
- 15. Электрофильными (ищущими, любящими электроны) называют реагенты, принимающие
- 16. В. Кроме гетеро- и гомолитических реакций существуют
- 17. 3. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ
- 18. В зависимости от вида реагента огромное количество
- 19. Механизмы реакций
- 20. Хлорирование, как правило, не удается остановить на
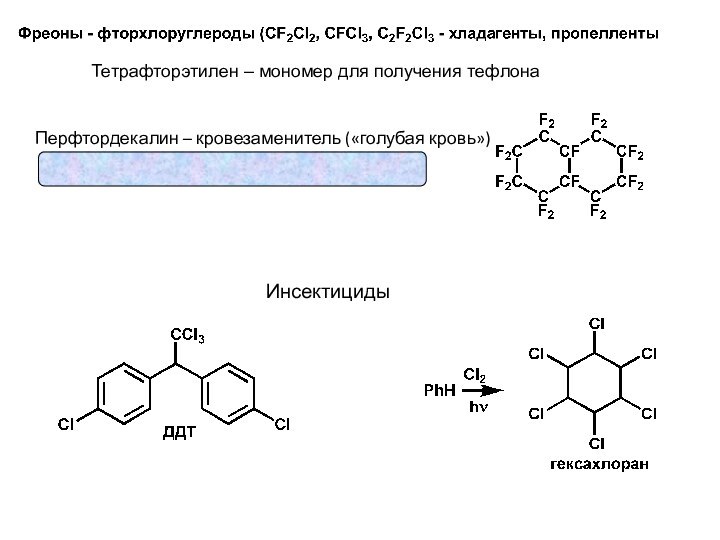
- 21. Тетрафторэтилен – мономер для получения тефлонаИнсектициды
- 22. Этот ряд соответствует ряду относительной стабильности алкильных
- 23. Реакция бромирования пропана чтобы решить вопрос, какой
- 24. Региоселективность реакций SR - реакции преимущественно
- 25. Этот ряд соответствует ряду относительной стабильности алкильных
- 26. Если алкан имеет более сложное строение, то
- 27. Реакции электрофильного замещения - SEМеханизм реакции SEДля
- 29. Механизм SE
- 30. РЕАКЦИИ АРОМАТИЧЕСКОГО ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ1.2.
- 31. При нитровании толуола С6Н5CH3 может происходить замещение не
- 32. Если в бензольном кольце содержится какой-либо заместитель,
- 34. Если в бензольном кольце имеются заместители 1
- 35. При наличии в бензоле двух заместителей, которые
- 36. РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ
- 37. У первичных алкилгалогенидов реакции нуклеофильного замещения протекают
- 38. Для третичных алкилгалогенидов и вторичных с объемными
- 39. РЕАКЦИИ ПРИСОЕДИНЕНИЯ (А )МЕХАНИЗМ РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО
- 40. Взаимодействие пропена (несимметричный алкен) с хлороводородом:В соответствии
- 41. При атаке на -связь электрофила (Н+ )
- 42. МарковниковВладимир Васильевич (1837-1904) 1869 -правилоХимические реакции имеют
- 43. Если в несимметричном алкене имеется электроноакцептор, или
- 44. МЕХАНИЗМ РЕАКЦИИ НУКЛЕОФИЛЬНОГО ПРИСОЕДИНЕНИЯ (АN)
- 45. Пространственная доступность карбонильного атома углерода уменьшается при
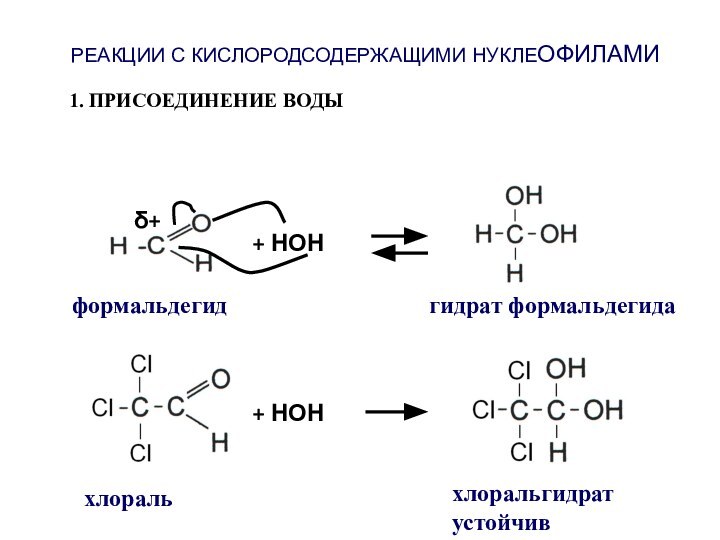
- 46. РЕАКЦИИ С КИСЛОРОДСОДЕРЖАЩИМИ НУКЛЕОФИЛАМИ1. ПРИСОЕДИНЕНИЕ ВОДЫ+ НОНформальдегидгидрат формальдегидаδ++ НОН хлоральхлоральгидрат устойчив
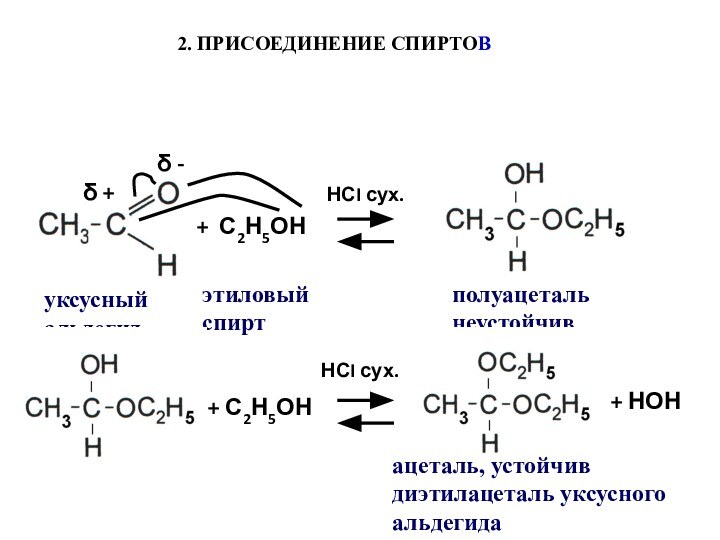
- 47. δ +δ -+ С2Н5ОННСI сух.2. ПРИСОЕДИНЕНИЕ СПИРТОВуксусный
- 48. Механизм реакции образования полуацеталейδ +:Н+ CI-[]+ CH3CH2OHCI-+ HCI
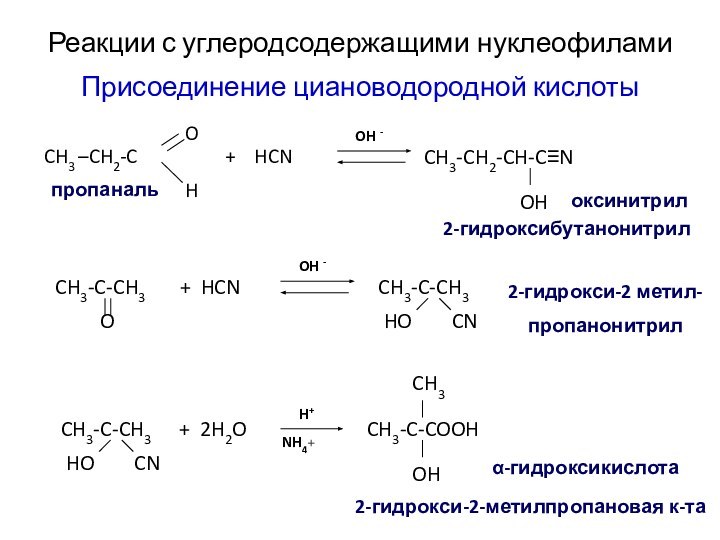
- 49. Реакции с углеродсодержащими нуклеофиламиПрисоединение циановодородной кислоты
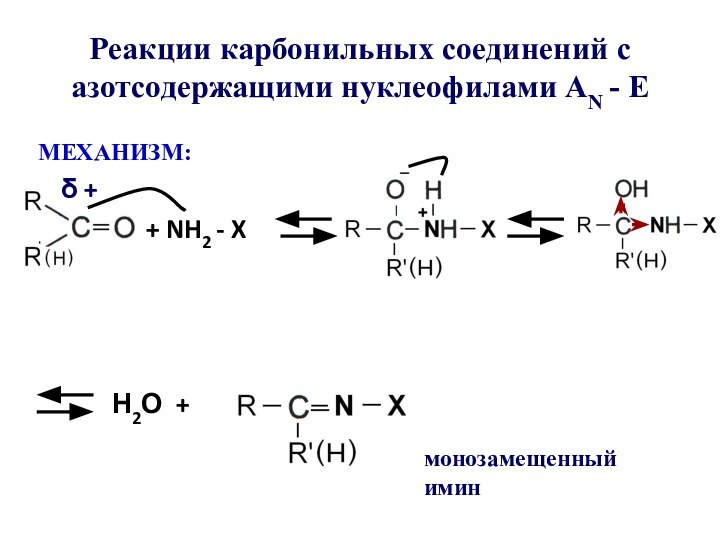
- 50. Реакции карбонильных соединений с азотсодержащими нуклеофилами АN - EМЕХАНИЗМ:+ NH2 - XН2О + монозамещенный иминδ +
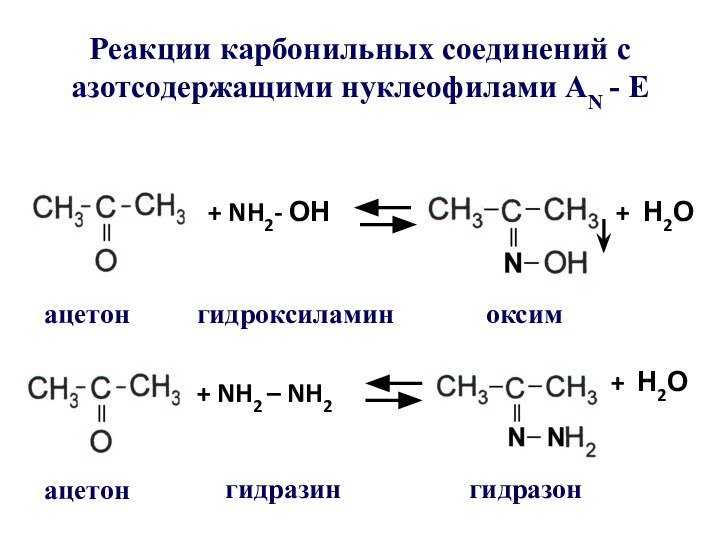
- 51. Реакции карбонильных соединений с азотсодержащими нуклеофилами АN - E+ NH2- ОН+ Н2Оацетонацетоноксим+ NH2 – NH2гидроксиламингидразингидразон+ Н2О
- 52. Скачать презентацию
- 53. Похожие презентации

































![Механизмы ограничения реакций Механизм реакции образования полуацеталейδ +:Н+ CI-[]+ CH3CH2OHCI-+ HCI](/img/tmb/13/1230434/0ab30699883eb70fadb8c66bf5f572a2-720x.jpg)
Слайд 3
Механизмом органической реакции называется совокупность всех
изменений, происходящих в реагирующей системе в ходе реакции:
- изменений
взаимного расположения атомов, -изменений в распределении электронной плотности,
- изменений энергии реагирующей системы.
Большинство органических реакций проходит, как правило, в несколько элементарных стадий, совокупность которых составляет механизм реакции.
Если в реакции участвуют два партнера, один из них часто называ-ют субстратом, другой – реагентом. Подразумевается, что субстрат-то, что изменяется, реагент - то, что изменяет субстрат (деление это довольно условное). Часто субстратом считают более сложное соеди-нение, реагентом более – просто; если взаимодействуют органическое и неорганическое соединения, то первое считают субстратом, а второе реагентом.
Слайд 4 Для доказательства механизма
реакции применяют химические методы (метод меченых атомов, изотопный метод,
кинетические и стереохимические методы) и физические методы.Лучшим доказательством механизма реакции является выделение из реакционной среды промежуточных продуктов или обнаружение их с помощью физических методов.
Механизм реакции должен объяснять все экспериментально полу-ченные данные и включать сведения о том, каким образом, в какой пос-ледовательности и какие связи разрываются в ходе реакции, как обра-зу-ются промежуточные и конечные продукты, из каких элементарных стадий состоит реакция, каковы относительные скорости каждой стадии и т. д.
Механизм реакции всегда следует рассматривать как гипотезу
с достаточной степенью достоверности. Нет ни одного механизма, который был бы известен полностью.
С появлением новых фактов механизм может уточняться и даже изменяться.
Слайд 5
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ
Разнообразные органические реакции
классифицируют по трем основным признакам:
направление (или конечный результат)
2.
способ разрыва и образования связей 3. молекулярность.
Слайд 6
Классификация органических реакций
ПО
КОНЕЧНОМУ РЕЗУЛЬТАТУ
Реакции замещения - S (substitution)
Pеакции присоединения - A
(addition)Pеакции элиминирования (отщепления)- Е (elimination)
Перегруппировки (миграция или перемещение какого либо фрагмента молекулы или миграция связи)
5. Окислительно-восстановительные реакции
Слайд 7
Классификация органических реакций по типу
1. Присоединение -
А
1,2-дибромэтан
2. Замещение - S
Слайд 9
5. Окислительно-восстановительные реакции (ОВР)
Окисление – процесс перехода
электронов от субстрата к окислителю.
Восстановление – процесс перехода электронов
от восстановителя к субстрату.Слайд 10 В зависимости от способа разрыва связей в атакующем
реагенте и субстрате различают три типа механизмов реакций:
А.гомолитический
(радикальный), Б.гетеролитический (ионный),В.перициклический (молекулярный). Классификация органических реакций по этому принципу зависит от того, как происходит разрыв и образование химических связей
2. Классификация органических реакций
ПО СПОСОБУ РАЗРЫВА СВЯЗЕЙ
Слайд 12 А. Если при разрыве химической связи у
каждого из атомов остаётся по одному электрону, такой тип
разрыва называют гомолитическим, или гомолизом (от греч. слов: гомо-одинаковый, лизис – расщепление).Гомолитическим, или свободнорадикальным, называют механизм, в котором при разрыве связей в реагирующих молекулах у каждого из образующихся фрагментов остается по одному электрону, эти нейтральные частицы с неспаренным электроном и есть радикалы. Радикалы не заряжены (электронейтральны), имеют неспаренный электрон, поэтому очень активны.
Такой тип разрыва химической связи характерен для неполярных и малополярных связей. Ему способствуют определённые внешние факторы: облучение, нагревание,проведение реакции в газовой фазе или в среде неполярного растворителя (чтобы исключить поляризацию связи).
Свободнорадикальный механизм обозначают символом R.
Слайд 13 Б. Если при разрыве связи пара электронов
остаётся у одного из атомов, такой тип разрыва называют
гетеролитическим, или гете-ролизом (гетерос - разный, другой). Такой тип разрыва характерен для полярных связей. Ему способствуют наличие полярного раствори-теля, нагревание, катализаторы (кислоты или щёлочи).Гетеролитическим, или ионным, называют механизм, в котором при разрыве связей в реагирующих молекулах оба электрона остаются на одном из образующихся фрагментов. Такие частицы называют ионами.
Реакции, протекающие по ионному механизму, в зависимости от электронной природы атакующего реагента делят на:
нуклеофильные (символ Nи ) и электрофильные (символ Е ).
В нуклеофильных реакциях атакующим реагентом является нуклеофил (Nи), в электрофильных — электрофил (Е ).
Слайд 14 Нуклеофильными (любящими, ищущими ядра) называют реагенты, которые отдают
электронную пару при образовании химичес-кой связи с субстратом.
К нуклеофильным
реагентам относят анионы и нейтральные молекулы, содержащие атомы с неподеленными парами электронов или центры с повышенной электронной плотностью.Типичные нуклеофильные реагенты :
1. Ионы, несущие отрицательный заряд (анионы): OH–, CN–, RO–, NH2 – ,
R-COO–, RS–, SH–, Cl–, Br–, I–, HSO3–, CNS– и др.;
2. Нейтральные молекулы, содержащие одну или несколько неподелен-
ных пар электронов: NH3, R-NH2, R2NH, R3N, H2O, R-OH, R-O-R и др.;
3. Молекулы, имеющие центры с повышенной электронной плотностью
(алкены, алкадиены, алкины, арены):>C=С<,-C=C-C=C-, -C≡C-,С6Н6 …
Нуклеофилы способны образовывать ковалентную связь с субстратом, атакуя в его молекуле центры с пониженной электронной плотностью.
Слайд 15 Электрофильными (ищущими, любящими электроны) называют реагенты, принимающие электронную
пару от субстрата при образовании с ним химической связи.
К
электрофильным реагентам относят катионы и нейтральные молеку-лы, имеющие вакантную орбиталь или центры с пониженной электрон-ной плотностью.Типичными электрофильными реагентами являются:
1. Ионы, несущие положительный заряд (катионы):протон (Н+), катионы металлов (Ме+), арилдиазоний-катион (Ar-N2+), протонированный оксид серы(VI) (HSO3+), нитроний катион (NO2+), нитрозо-катион (NO+) и др.;
2. Нейтральные молекулы, имеющие вакантную орбиталь: SO3, кислоты
Льюиса (АlСl3, FeВr3, SnCl4, ВF3 и др.);
3. Молекулы, имеющие центры с пониженной электронной плотностью: галогенопроизводные углеводородов ( C-Halδ+), карбонилсодержащие соединения >Cδ+ =O, а также галогены Cl2, Br2, I2.
Электрофильные реагенты способны образовывать ковалентную связь с субстратом, атакуя в его молекуле центры с повышенной электронной плотностью.Электрофильные и нуклеофильные реакции, подобно про-цессам окисленияи восстановления, неразрывно связаны между собой, то есть в зависимости
Слайд 16 В. Кроме гетеро- и гомолитических реакций существуют реакции,
которые сопровождаются одновременным (согласованным) разрывом и образованием связей. Такие
реакции называют молекулярными (синхронными, согласованными).Типичным примером таких реакций является диеновый синтез
(реакция Дильса-Альдера):
диен диенофил
Слайд 17
3. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ
В ЗАВИСИМОСТИ ОТ МОЛЕКУЛЯРНОСТИ
В зависимости от молекулярности (число частиц
молекул), участвующих в лимитирующей стадии, определяющей скорость химической реакции (самая медленная стадия) различают:
моно-, би- и тримолекулярные реакции.
Молекулярность больше трех не наблюдается и обозначается цифровыми индексами «1» , «2» и «3» ,соответственно.
Слайд 18 В зависимости от вида реагента огромное количество органических
реакций можно разделить на несколько основных типов.
1. Реакции присоединения
(А или Ad ): A = В + Х—Y → АХ—ВYОни характерны для соединений, имеющих кратные связи между атомами угле-рода, углерода и кислорода, углерода и азота, азота и азота, а также для соеди-
нений, содержащих атомы с неподеленными электронными парами и вакантны-ми орбиталями. Реакции присоединения могут происходить по следующим возможным механизмам:
а) электрофильное присоединение (АE);
б) нуклеофильное присоединение (АN);
в) радикальное присоединение (AR);
г) молекулярное (синхронное) присоединение.
2. Реакции замещения (S): A—В + Х—Y → А—Х + В—Y
характерны для всех классов органических соединений и могут протекать
по следующим механизмам:
а) электрофильное замещение (SE);
б) нуклеофильное замещение (SN);
в) радикальное замещение (SR).
3. Реакции элиминирования (Е ): АХ—ВY → A = В + Х—Y
От органических соединений чаще всего отщепляются такие вещества, как во-да, галогеноводороды, аммиак. Реакции отщепления характерны для галоге-нопроизводных углеводородов, спиртов, галогено-, гидрокси- и аминокислот и приводят к образованию кратных связей
Слайд 19 Механизмы реакций замещения
1. РЕАКЦИИ РАДИКАЛЬНОГО ЗАМЕЩЕНИЯ (SR )
Данный механизм реакций характерен
для алканов, циклоалканов, алифати-ческих радикалов других соединений.Ковалентные -связи этих соединений х неполярны или малополярны, поэтому для них энергетически выгоден гомоли-тический разрыв связи. Свободные радикалы могут возникать за счет терми-ческого (термолиз) или фотохимического (фотолиз) инициирования, а также в результате ОВ реакций.Реакции галогенирования протекают по цепному радикальному механизму,
который включает следующие стадии:
1. Инициирование цепи Cl2 2 Cl
2. Рост цепи RH + Cl → R + HCl
R + Cl2 → RCl + Cl
3. Обрыв цепи 2 R → R-R
R + Cl → RCl
2 Cl → Cl2
Слайд 20 Хлорирование, как правило, не удается остановить на стадии
монозамещения.
Так, при хлорировании метана образуется смесь продуктов моно-
и полихлорирования:
Слайд 22 Этот ряд соответствует ряду относительной стабильности алкильных радикалов:
Алкильные группы за счет +I-эффекта увеличивают электронную плотность
в радикальном
центре и тем самым частично заполняют одноэлектронную орбиталь вторым электроном, приводя по существу к делокализации. Свободные ра
дикалы, в которых одноэлектронная орбиталь находится в сопряжении с π-электронной системой кратных связей, являются более устойчивыми, так как в данном случае делокализация неспаренного электрона происходит по всей сопряженной системе:
Слайд 23
Реакция бромирования пропана
чтобы решить вопрос, какой из
продуктов будет преобладать, нужно описать ме-ханизм данной реакции. Известно,чем
стабильнее промежуточная частица реак-ции ,тем больше вероятность её образования. Необходимо сравнить стабильность двух возможных свободных радикалов, образующихся на стадии роста цепи. Свободные радикалы в целом очень нестабильны, т.к.имеют неспаренный элект-рон, они «ищут» пару электрону и легко вступают в реакции. Радикал изопропил относительно более устойчив, чем пропил. Это можно объяснить, показав смещение электронной плотности в данных радикалах.Пропил – первичный радикал, изопропил–вторичный и электронная плотность сме-щается к углероду с неспаренным электроном с двух сторон, что способствует ста-билизации радикала.Вероятность образования радикала изопропила на стадии роста цепи выше,а значит, в дальнейшем именно радикал изопропил имеет больше шансов прореагировать с новой молекулой брома и образовать конечный продукт реакции – 2-бромпропан.
Слайд 24
Региоселективность реакций SR - реакции преимущественно протекают по
одному из нескольких возможных реакционных центров (с образованием наиболее
стабильных радикалов: для алканов - понаиболее замещенному атому углерода)Слайд 25 Этот ряд соответствует ряду относительной стабильности алкильных радикалов:
Алкильные группы за счет +I-эффекта увеличивают электронную плотность
в радикальном
центре и тем самым частично заполняют одноэлектронную орбиталь вторым электроном, приводя по существу к делокализации. Свободные ра
дикалы, в которых одноэлектронная орбиталь находится в сопряжении с π-электронной системой кратных связей, являются более устойчивыми, так как в данном случае делокализация неспаренного электрона происходит по всей сопряженной системе:
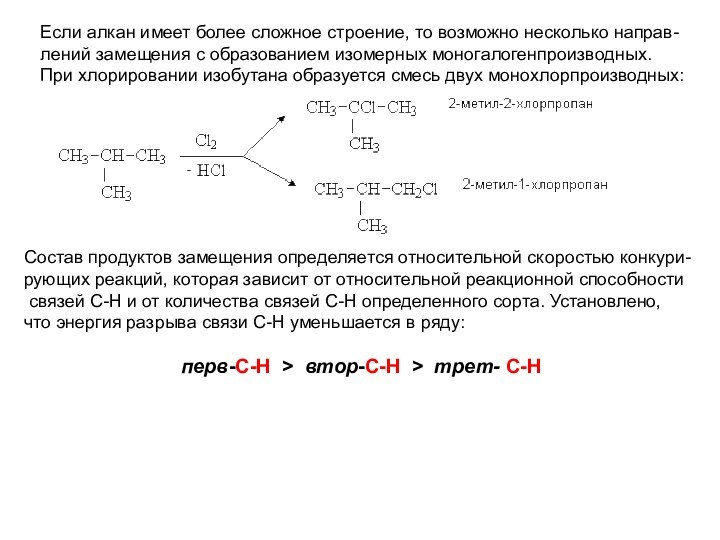
Слайд 26 Если алкан имеет более сложное строение, то возможно
несколько направ-
лений замещения с образованием изомерных моногалогенпроизводных.
При хлорировании
изобутана образуется смесь двух монохлорпроизводных: Состав продуктов замещения определяется относительной скоростью конкури-
рующих реакций, которая зависит от относительной реакционной способности
связей С-Н и от количества связей С-Н определенного сорта. Установлено,
что энергия разрыва связи С-Н уменьшается в ряду:
перв-С-Н > втор-C-Н > трет- С-Н
Слайд 27
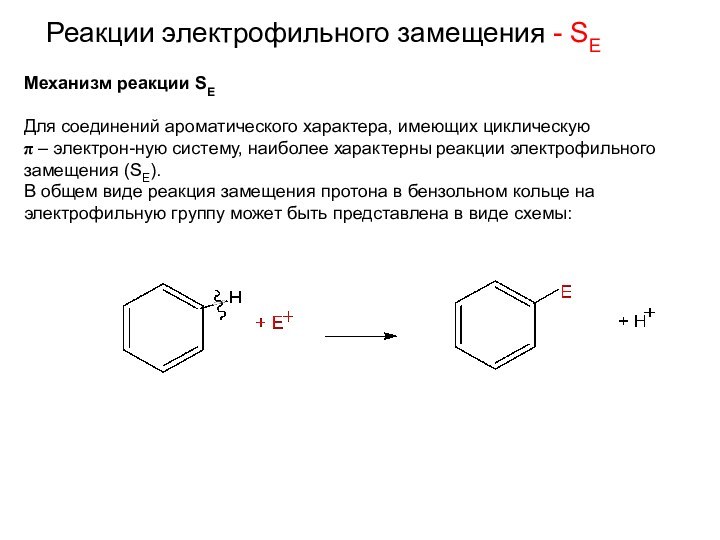
Реакции электрофильного замещения - SE
Механизм реакции SE
Для соединений
ароматического характера, имеющих циклическую
π – электрон-ную систему, наиболее
характерны реакции электрофильного замещения (SE). В общем виде реакция замещения протона в бензольном кольце на электрофильную группу может быть представлена в виде схемы:
Слайд 28
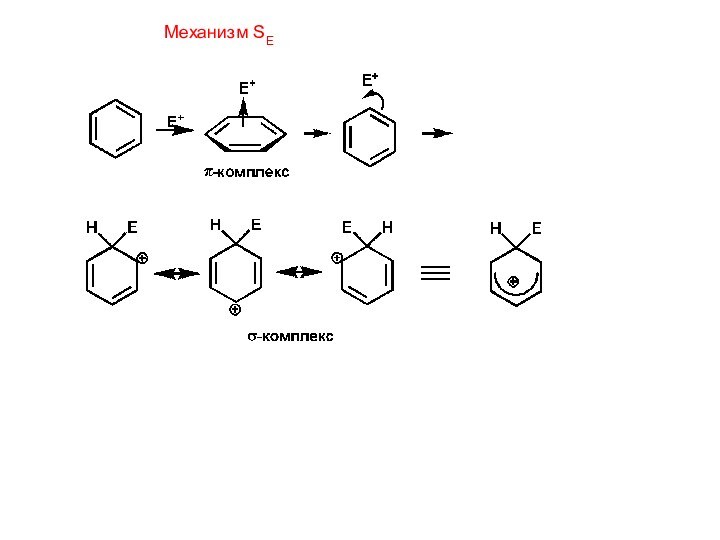
Механизм включает ряд
стадий.1. Образование электрофильной частицы E+:
2. Образование π–комплекса: электрофильная частица притягивается сексте-
том π–электронов молекулы бензола с образованием π–комплекса.
3. Образование σ– комплекса и конечного продукта:
Электрофил забирает два электрона из бензольного кольца и образует σ–связь с атомом углерода. При этом нарушается ароматичность,т.к.атом углерода коль-ца перешел в sp3-гибридное состояние и образовался σ-комплекс, этот процесс протекает наиболее медленно. Вторая стадия, связанная с отщеплением прото-на, идет быстро. Ароматическая система восстанавливается и недостающая до секстета пара электронов, связывающая атом водорода с кольцом возвращает-ся в кольцо.
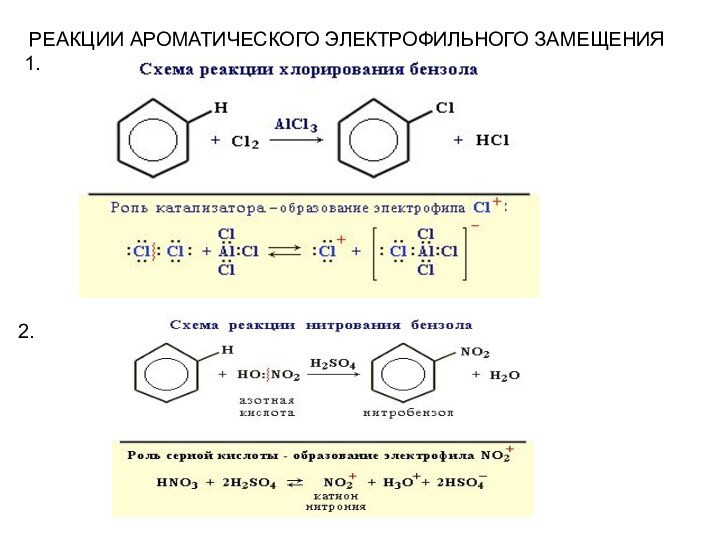
Слайд 31
При нитровании толуола С6Н5CH3 может происходить замещение не одного,
а трех атомов водорода с образованием
2,4,6-тринитротолуола:Слайд 32 Если в бензольном кольце содержится какой-либо заместитель, то
под его влия-нием происходит перераспределение π-электронной плотности цикла и
новая группа вступает уже в определенные положения по отношению к имеющемуся заместителю.В реакциях SE монозамещенных бензола, в зависимости от элект-ронной природы заместителя, вступающая группа может занимать преимущест-венно орто-, мета- или пара-положения, а реакция соответственно протекать быстрее или медленнее, чем с незамещенным бензолом.По влиянию на направление реакций электрофильного замещения и реакцион-ную способность бензольного кольца заместители можно разделить на две группы: заместители I рода (орто-, пара-ориентанты) и заместители II рода
К заместителям Iрода относятся атомы и атомные группы, проявляющие положительный индуктивный или положительный мезомерный эффекты: -О-, -NR->, -NHR, -NH2, -ОН, -OR, -NHCOR, -OCOR, - SR, -F, -CI, Br,
К заместителям IIрода относятся группы, проявляющие отрицательный индуктивный или отрицательный мезомерный эффекты:
-NR3, -NH3, -N02, -S03H, -CN, -CHO, -COR, -COOH, -COOR, -CONH2, и др.
Слайд 34 Если в бензольном кольце имеются заместители 1 и
2 рода,то введение третьего заместителя определяет заместитель 1 рода.
Если
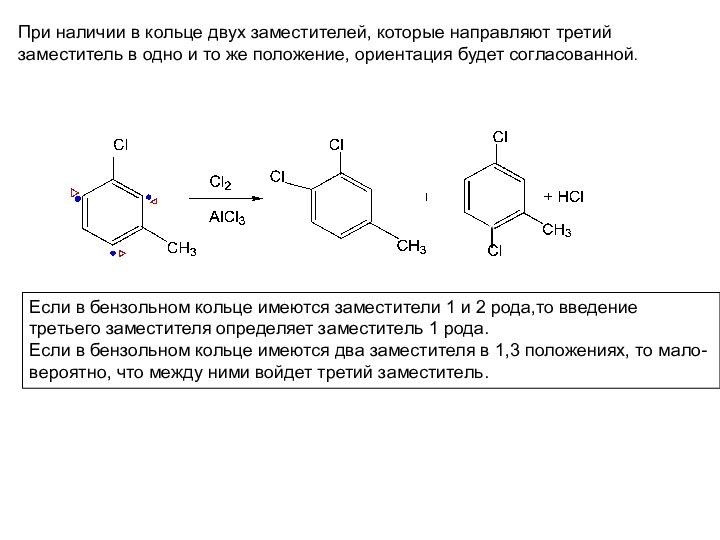
в бензольном кольце имеются два заместителя в 1,3 положениях, то мало-вероятно, что между ними войдет третий заместитель.При наличии в кольце двух заместителей, которые направляют третий
заместитель в одно и то же положение, ориентация будет согласованной.
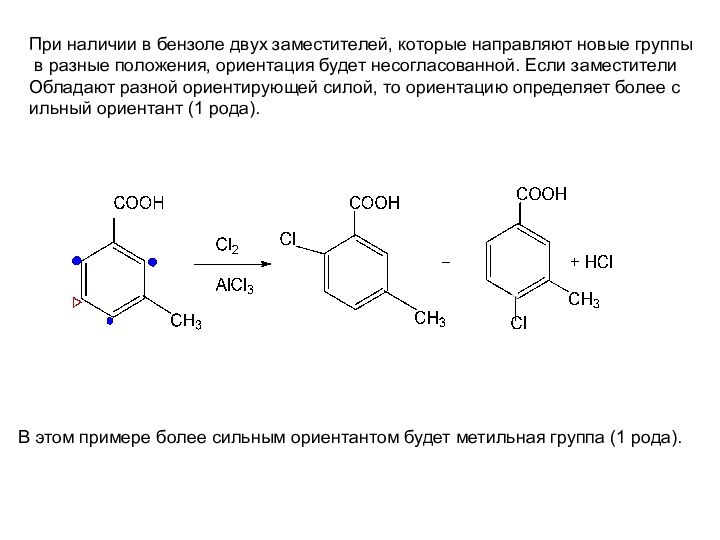
Слайд 35 При наличии в бензоле двух заместителей, которые направляют
новые группы
в разные положения, ориентация будет несогласованной. Если
заместители Обладают разной ориентирующей силой, то ориентацию определяет более с
ильный ориентант (1 рода).
В этом примере более сильным ориентантом будет метильная группа (1 рода).
Слайд 36 РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ (SN
)
Нуклеофильное замещение у насыщенного атома углерода
Реакции нуклеофильного замещения у
насыщенного атома углерода характерны для галогенопроизводных, спиртов и простых эфиров. Для них установлено, что нуклеофильное замещение может протекать по двум механизмам: SN1 и SN2.Наличие в молекуле электрофильного центра обуславливает реакции SN. В алкилгалогенидах и спиртах из-за различия в электроотрицательности СГал и СОН , связь сильно поляризована, что приводит к появлению электрофиль-ного центра, т. е. атома углерода несущего частично положительный заряд ( Такой атом углерода в процессе химической реакции будет подвергаться атаке нуклеофильным реагентом:
В процессе реакции происходит гетеролитический разрыв связи С–Х, электроны
связи переходят к электроотрицательному элементу Х, а новая связь С–Nu
образуется за счет пары электронов нуклеофильного реагента.
Слайд 37 У первичных алкилгалогенидов реакции нуклеофильного замещения протекают по
бимолекулярному механизму (SN2). Взаимодействие бромистого этила с водным раствором
гидроксида натрия, приводит к образованию спирта:Механизм реакции: в водном растворе щелочь диссоциирует с образованием гидроксид иона ОН, который является нуклеофилом. Атом углерода, связанный с бромом, находится в sp3-гибридизованном состоянии и имеет тетраэдричес-кую конфигурацию. Нуклеофил ОН приближается к электрофильному центру с электростатически наиболее выгодной стороны (атака с тыла), что приводит к формированию плоскостного (sp2-гибридизация) переходного состояния:
Образование новой связи С–ОН и разрыв старой связи С–Вr происходят одновре-менно. Скорость реакции в целом зависит от концентрации двух частиц-субстра-та и нуклеофила, поэтому описанный механизм - SN2 (бимолекулярный).
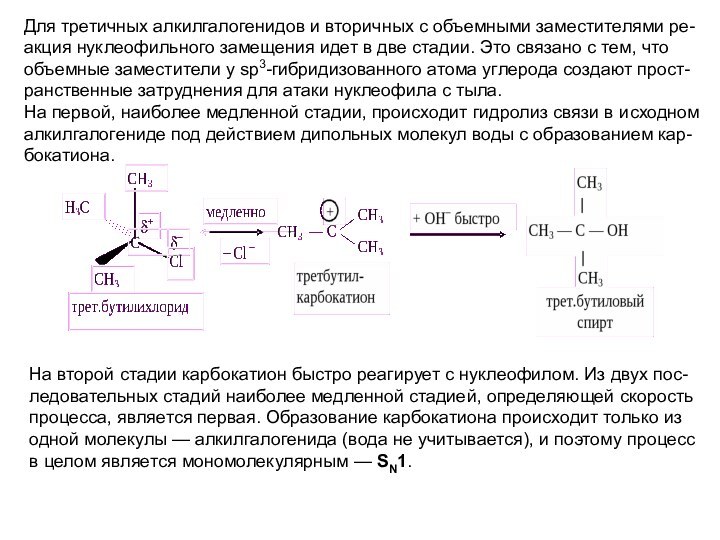
Слайд 38 Для третичных алкилгалогенидов и вторичных с объемными заместителями
ре-акция нуклеофильного замещения идет в две стадии. Это связано
с тем, что объемные заместители у sp3-гибридизованного атома углерода создают прост-ранственные затруднения для атаки нуклеофила с тыла. На первой, наиболее медленной стадии, происходит гидролиз связи в исходном алкилгалогениде под действием дипольных молекул воды с образованием кар-бокатиона.На второй стадии карбокатион быстро реагирует с нуклеофилом. Из двух пос-ледовательных стадий наиболее медленной стадией, определяющей скорость процесса, является первая. Образование карбокатиона происходит только из одной молекулы — алкилгалогенида (вода не учитывается), и поэтому процесс в целом является мономолекулярным — SN1.
Слайд 39
РЕАКЦИИ ПРИСОЕДИНЕНИЯ (А )
МЕХАНИЗМ РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ПРИСОЕДИНЕНИЯ
(АЕ)
При действии электрофильного реагента на изолированную
двойную связь про-исходит разрыв менее прочной -связи, и результатом реакции является присо-единение. Реакция протекает стадийно через образование - и -комплексов:Скорость лимитирующая стадия реакции — образование -комплекса.
Слайд 40
Взаимодействие пропена (несимметричный алкен) с хлороводородом:
В соответствии с
эмпирическим правилом Марковникова водород присое-динится к наиболее гидрированному атому
углерода, а галоген к наименее гидрированному, т. е. реакция приводит к одному из двух возможных изомерных продуктов присоединения (региоселективная реакция). В исходном алкене -связь поляризована за счет +ICH3. В результате на первом углеродном атоме возникает избыточная электронная плотность, что будет облегчать атаку электрофила именно по этому углеродному атому (статический фактор).Слайд 41 При атаке на -связь электрофила (Н+ ) возможно
образование двух карбокатионов,
причем более устойчивым будет вторичный, так
как две метильные группы, обладающие +I СН3, лучше компенсируют положительный заряд, чем одна
этильная группа (динамический фактор.
Химические реакции имеют тенденцию идти в направлении образования более стабильных частиц, то оба фактора действуют согласованно, что и приводит к образованию 2-хлорпропана. Если статический и динамический факторы противоположны, доминирует динамический фактор.
Слайд 42
Марковников
Владимир Васильевич
(1837-1904)
1869 -правило
Химические реакции имеют тенденцию
идти в направлении образования более стабильных частиц, то оба
фактора действуют согласованно, что и приводит к образованию 2-хлорпропана. Если статический и динамический факторы противоположны, доминирует динамический фактор.Современное правило Марковникова имеет следующую интерпретацию:
направление присоединения реагентов типа НХ к несимметричным непредельным соединениям определяется действием статического (распределение электронной плотности до начала атаки реагента) и динамического (устойчивость образующихся промежуточных катионов) факторов
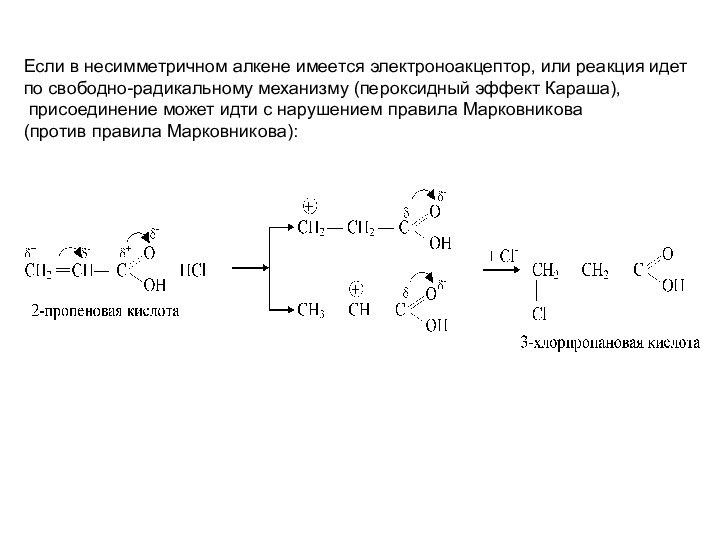
Слайд 43 Если в несимметричном алкене имеется электроноакцептор, или реакция
идет
по свободно-радикальному механизму (пероксидный эффект Караша),
присоединение может
идти с нарушением правила Марковникова (против правила Марковникова):
Слайд 44
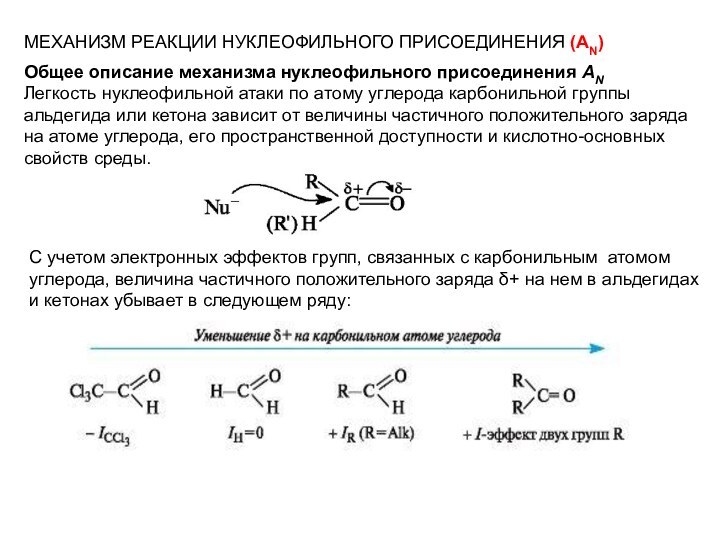
МЕХАНИЗМ РЕАКЦИИ НУКЛЕОФИЛЬНОГО ПРИСОЕДИНЕНИЯ (АN)
Общее
описание механизма нуклеофильного присоединения AN
Легкость нуклеофильной атаки по атому
углерода карбонильной группы альдегида или кетона зависит от величины частичного положительного заряда на атоме углерода, его пространственной доступности и кислотно-основных свойств среды.С учетом электронных эффектов групп, связанных с карбонильным атомом углерода, величина частичного положительного заряда δ+ на нем в альдегидах
и кетонах убывает в следующем ряду:
Слайд 45 Пространственная доступность карбонильного атома углерода уменьшается при замене
водорода более объемистыми органическими радикалами, поэтому
альдегиды более реакционноспособны,
чем кетоны.Общая схема реакций нуклеофильного присоединения AN к карбонильной
группе включает нуклеофильную атаку по карбонильному атому углерода,
за которой следует присоединение электрофила к атому кислорода.