- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Элементы главной подгруппы III группы
Содержание
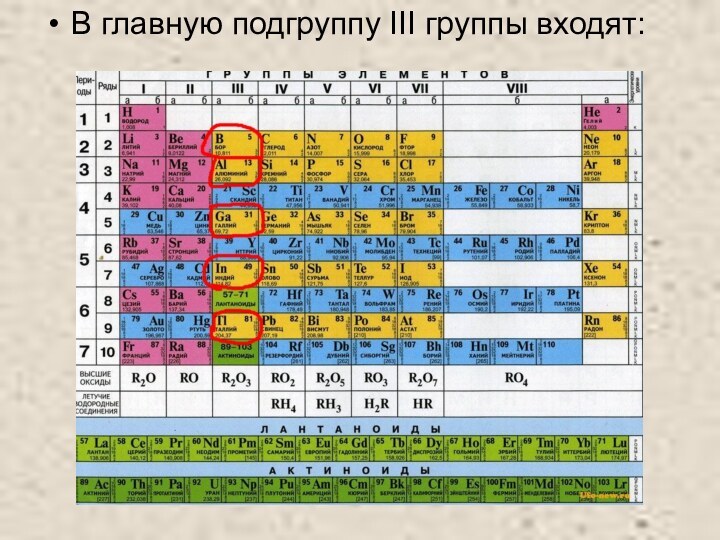
- 2. В главную подгруппу III группы входят:
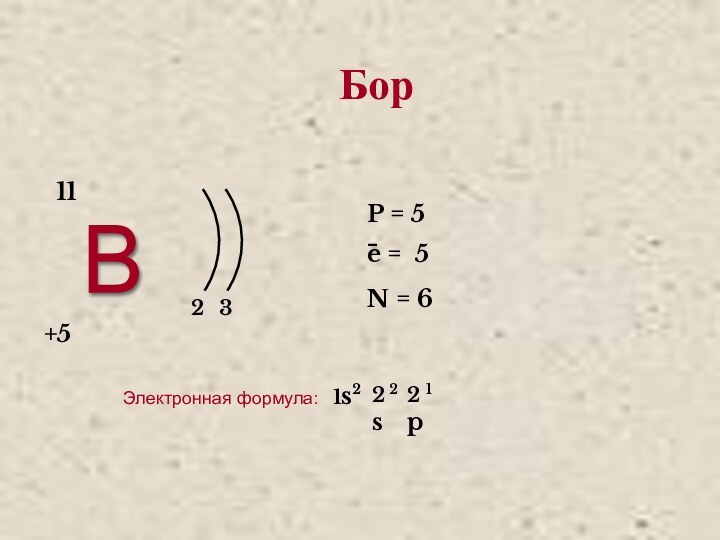
- 3. В 23 +5 11P = 5e = 5N = 6−Электронная формула:Бор
- 4. Алюминий Al 27+130283P = 13e = 13N = 14−Электронная формула:Al Al
- 5. ГаллийGa +317028183P = 31e = 31N = 39−Электронная формула:
- 6. ИндийIn115+498183182P = 49e = 49N = 66Электронная формула:−
- 7. Таллий−Tl 818322183P = 81e = 81N = 123204+81Электронная формула:
- 8. Общая характеристикаНа внешнем электронном уровне элементов главной
- 9. Бор Бор (от лат. Borum). В свободном состоянии бор —
- 10. АлюминийАлюми́ний (от лат. Aluminium)-лёгкий, парамагнитный металл серебристо-белого цвета, легко
- 11. Галлий.Га́ллий (от лат. Gallium) мягкий пластичный металл
- 12. Индий.И́ндий (от лат. Indium) ковкий, легкоплавкий, очень мягкий металл
- 13. Таллий.Та́ллий (от лат. Thallium) мягкий металл белого
- 14. Применение.Бор
- 15. ПрименениеАлюминий
- 16. Применение.Галлий
- 17. Применение.Индий
- 18. Применение.Таллий
- 19. Химические свойстваЛегко реагирует с простыми веществами:1. С
- 20. 2. С галогенами (кроме фтора), образуя хлорид,
- 21. с другими неметаллами реагирует при нагревании: с
- 22. с серой, образуя сульфид алюминия: 2Al +
- 23. с азотом, образуя нитрид алюминия: 2Al +
- 24. с углеродом, образуя карбид алюминия: Al +
- 25. Со сложными веществами:с водой (после удаления защитной
- 26. Скачать презентацию
- 27. Похожие презентации
В главную подгруппу III группы входят:























Слайд 8
Общая характеристика
На внешнем электронном уровне элементов главной подгруппы
имеется по три электрона (s2р1). Они легко отдают эти
электроны или образуют три неспаренных электрона за счет перехода одного электрона на р-уровень. Для бора и алюминия характерны соединения только со степенью окисления +3. В отличие от алюминия галлий обладает явно неметаллическими свойствами. Эти свойства в ряду Gа, In, Тl ослабевают, а металлические свойства усиливаются.Все элементы III группы обладают очень сильным сродством к кислороду, и образование их оксидов сопровождается выделением большого количества теплоты.
Слайд 9
Бор
Бор (от лат. Borum). В свободном состоянии бор — бесцветное,
серое или красное кристаллическое либо тёмное аморфное вещество.
Чрезвычайно
твёрдое вещество (уступает только алмазу, нитриду углерода, нитриду бора (боразону), карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана). Обладает хрупкостью и полупроводниковыми свойствами (широкозонный полупроводник).
Слайд 10
Алюминий
Алюми́ний (от лат. Aluminium)-лёгкий, парамагнитный металл серебристо-белого цвета, легко поддающийся
формовке, литью, механической обработке. Относится к группе лёгких металлов.
Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.
Слайд 11
Галлий.
Га́ллий (от лат. Gallium) мягкий пластичный металл серебристо-белого
цвета с синеватым оттенком. Относится к группе лёгких металлов.
Одной
из особенностей галлия является широкий температурный интервал существования жидкого состояния (от 30 и до 2230 °C), при этом он имеет низкое давление пара при температурах до 1100—1200 °C.
Слайд 12
Индий.
И́ндий (от лат. Indium) ковкий, легкоплавкий, очень мягкий металл серебристо-белого
цвета. Относится к группе лёгких металлов.
Сходен по химическим
свойствам с алюминием и галлием, по внешнему виду с цинком.
Слайд 13
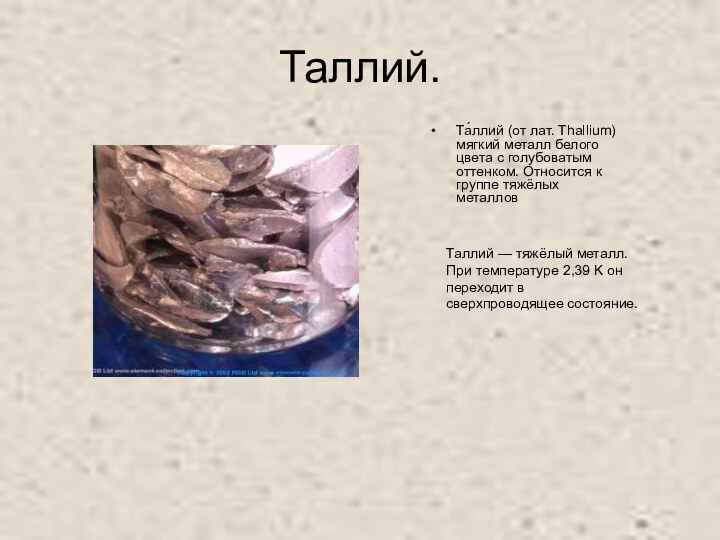
Таллий.
Та́ллий (от лат. Thallium) мягкий металл белого цвета
с голубоватым оттенком. Относится к группе тяжёлых металлов
Таллий —
тяжёлый металл. При температуре 2,39 K он переходит в сверхпроводящее состояние.
Слайд 19
Химические свойства
Легко реагирует с простыми веществами:
1. С кислородом,
образуя оксид алюминия:
Al + O2 =
Задание №
1 Составьте уравнение реакции, расставьте коэффициенты с помощью электронного баланса
Проверим.
4Al + 3O2 = 2Al2O3
Слайд 20 2. С галогенами (кроме фтора), образуя хлорид, бромид
или иодид алюминия:
Al + Cl2 =
Задание
№2Составьте уравнение реакции, расставьте коэффициенты с помощью
электронного баланса
Проверим.
2Al + 3Cl2 = 2AlCl3
Слайд 21
с другими неметаллами реагирует при нагревании:
с фтором,
образуя фторид алюминия:
Al + F2 =
Задание №3
Составьте
уравнение реакции, расставьте коэффициенты с помощьюэлектронного баланса
Проверим
2Al + 3F2 = 2AlF3
Слайд 22
с серой, образуя сульфид алюминия:
2Al + S
=
Задание №4
Составьте уравнение реакции, расставьте коэффициенты с помощью
электронного
балансаПроверим
2Al + 3S = Al2S3
Слайд 23
с азотом, образуя нитрид алюминия:
2Al + N
=
Задание №5
Составьте уравнение реакции, расставьте коэффициенты с помощью
электронного
балансаПроверим
2Al + N2 = 2AlN
Слайд 24
с углеродом, образуя карбид алюминия:
Al + 3С
=
Задание №6
Составьте уравнение реакции, расставьте коэффициенты с помощью
электронного баланса
Проверим
4Al
+ 3С = Al4С3
Слайд 25
Со сложными веществами:
с водой (после удаления защитной оксидной
пленки, например, амальгамированием или растворами горячей щёлочи):
2Al +
Н2O = Задание №7
Составьте уравнение реакции, расставьте коэффициенты с помощью
электронного баланса
Проверим
2Al + 6H2O = 2Al(OH)3 + 3H2