- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Железо
Содержание
- 2. Проверка домашнего заданияУпражнение №5 Al2 (SO4)3+ KOH(нед)
- 3. ОтветыУпражнения №51.Al2 (SO4)3 + 6KOH(нед.) = 2AL(OH)3
- 4. Упражнение №62Al +3Cl2 = 2AlCl3AlCl3 + 3NaOH
- 5. Изучение нового материалаХарактеристика по плану:1.Положение железа в
- 6. Характеристика элемента4-период, 4ряд, 8-группа, побочная подгруппа, порядковый
- 7. Физические свойства железаСеребристо-серый, мягкий металл, обладает хорошей
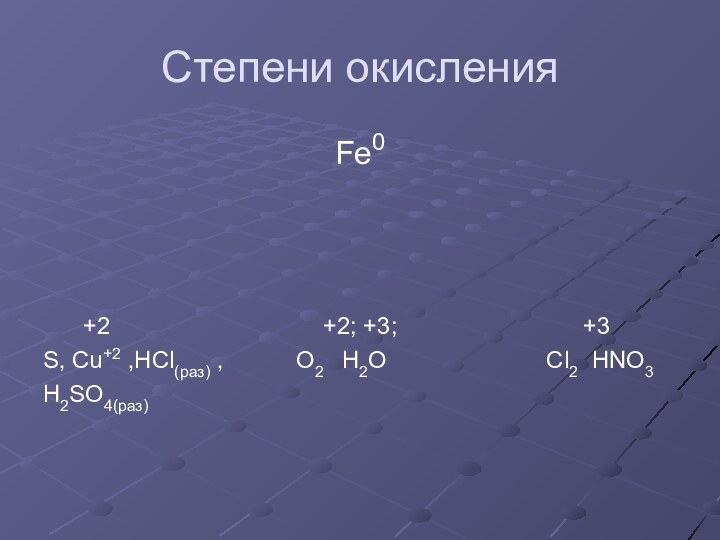
- 8. Степени окисленияFe0 +2
- 9. Химические свойстваПри нагревании2Fe + 3Cl2 =2FeCl33Fe +2O2=
- 10. Химические свойства Fe + CuSO4 = Cu
- 11. При нагревании2Fe + 6H2SO4(k)=Fe2(SO4)3 + 3SO2+6H2OFe+ 6HNO3(k)= Fe(NO3)3+ 3NO2+ 3H2O
- 12. Химические свойства Fe0
- 13. Уравнивание реакций5Fe0 + 12 HN+5 O3 (p)
- 14. Минералы железоFe3O4 магнитный железняк или магнетит Fe2O3
- 15. ПрименениеМагнитный, красный, бурый железняки –для производства черной
- 16. Источники железаШпинатСалатКапустаЧерная черешняГовядинаТелятина
- 17. Скачать презентацию
- 18. Похожие презентации
Проверка домашнего заданияУпражнение №5 Al2 (SO4)3+ KOH(нед) = Al 2(SO4)3+ KOH(изб.) = Упражнение №6Al ? AlCl3 ? Al(OH)2 ? Al2 O3 ? NaAlO2 ? Al 2(SO4)3 ? Al(OH)3 ? AlCl3 ? NaAlO2















![Железо Качественная реакция на катионы железаK3[Fe(CN)6]—красная кровяная сольK4[Fe(CN)6]– желтая кровяная сольFeCl2+ K3[Fe(CN)6 =](/img/tmb/11/1068655/2bc12ad53bfeae632faacf3a32266d06-720x.jpg)
Слайд 2
Проверка домашнего задания
Упражнение №5
Al2 (SO4)3+ KOH(нед) =
Слайд 3
Ответы
Упражнения №5
1.Al2 (SO4)3 + 6KOH(нед.) = 2AL(OH)3 +3K2SO4
2.
Al2 (SO4)3 + 8KOH(изб) = 2KAlO2 + 3K2SO4 +
4H2O
Слайд 4
Упражнение №6
2Al +3Cl2 = 2AlCl3
AlCl3 + 3NaOH =Al(OH)3
+ 3NaCl
2Al(OH)3 = Al2O3 + 3H2O
Al2O3 +2NaOH =2NaAlO2 +
H2O2NaAlO2 + 4H2SO4(изб.) = Na2SO4 + Al2 (SO4 )3 +4H2O
Al2 (SO4 ) + 6NaOH = 2Al (OH)3 + 3Na2 SO4
Al(OH)3 +3HCl =AlCl3 + 3H2O
AlCl3 + 4NaOH(избыт.)= NaAlO2 + 3NaCl + 2H2O
Слайд 5
Изучение нового материала
Характеристика по плану:
1.Положение железа в ПСХЭ
(период, ряд, группа, подгруппа, порядковый номер)
2.Атомное строение(число электронов, протонов
, нейтронов, относительная атомная масса)3.Электронные слои, распределение электронов по слоям, электронная конфигурация.
Слайд 6
Характеристика элемента
4-период, 4ряд, 8-группа, побочная подгруппа, порядковый номер
26
26 электронов, 26 протонов, относительная атомная масса 56, 30
нейтронов.4 электронных слоя, 2)8)14)2), электронная конфигурация 1s22s2p63s2p6d64s2
Степень окисления 0,+2, +3 ,+4 и иногда + 6; является восстановителем
Слайд 7
Физические свойства железа
Серебристо-серый, мягкий металл, обладает хорошей пластичностью,
ковкостью и способностью к намагничиванию.
Плотность 7,864г/см3, температура плавления 1539
* С
Слайд 9
Химические свойства
При нагревании
2Fe + 3Cl2 =2FeCl3
3Fe +2O2= Fe3O4
(FeO Fe2O3)
Fe +S =FeS
При очень высокой температуре
4Fe + 3C
=Fe4C34Fe + 3Si =Fe4Si3
3Fe + 2P = Fe3P2
Слайд 10
Химические свойства
Fe + CuSO4 = Cu +
FeSO4
Fe + 2HClр = FeCl2 + H2
Fe + H2SO4
p= FeSO4 + H2Fe + H2SO4(k) =/=
Fe + HNO3 (к)=/=
Слайд 12 Химические свойства Fe0 + HNO3 (p) = Fe +2(NO3
)2 + N20 + H2 O Fe0 + HNO3(р)
= Fe+3 (NO3)3 + N+2 O + H20 Fe0 + HNO3(р) = Fe+2(NO3)2 + N-3 H4 N+5 O3+ H2O
Слайд 13
Уравнивание реакций
5Fe0 + 12 HN+5 O3 (p) =
5Fe +3(NO3 )2 + N20 +6 H2 O
вос-ль окис-льFe0 - 2e = Fe+2 10 1 2N+5 + 10e = N20 2 5
Fe0 +4 HN+5 O3 = Fe+3 (NO3)3 + N+2 O + 2H20 Fe0 - 3e = Fe+3 3 1 N+5 + 3e = N+2 3 1
Fe0 – восстановитель
HNO3 – окислитель
4Fe0 +10 HNO3 =4 Fe+2(NO3)2 + N-3 H4 N+5 O3+ 3H2O
вос-ль окис-ль
Fe0 - 2e = Fe+2 8 4 N+5 + 8e = N-3 2 1
Слайд 14
Минералы железо
Fe3O4 магнитный железняк или магнетит
Fe2O3
красный железняк или гематит
2Fe2O3.3H2O бурый железняк или лимонит
FeS2 железный
или серный колчеданFeSO4.7H2O железный купорос
Слайд 15
Применение
Магнитный, красный, бурый железняки –для производства черной металлургии
(чугуна и стали)
Железный колчедан – для производства серной кислоты
Железный
купорос– для борьбы с вредителями растений, для приготовления минеральных красок, для обработки древесины Соединение железа издавна применяют для лечения малокровия, при истощении, упадке сил.
Чугун и сталь в технике и в быту.
Хлорид железа(lll)– при очистке воды, в качестве протравы при крашении тканей.
Сульфат железа(lll) при очистке воды, в качестве растворителя в гидрометаллургии .