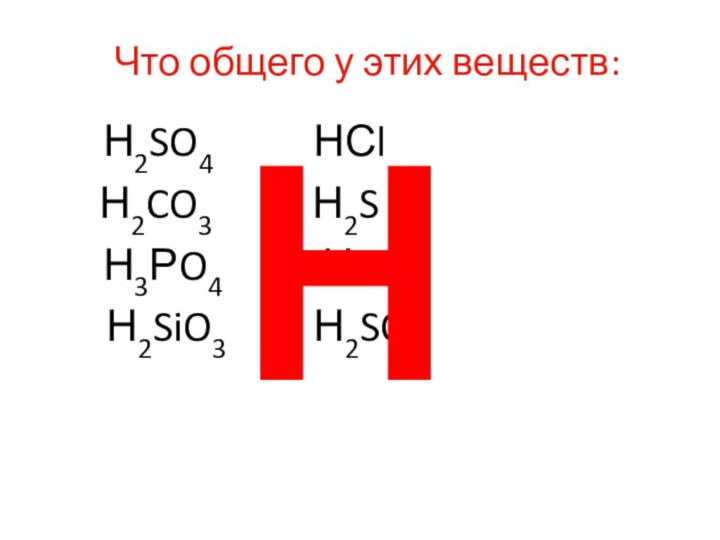
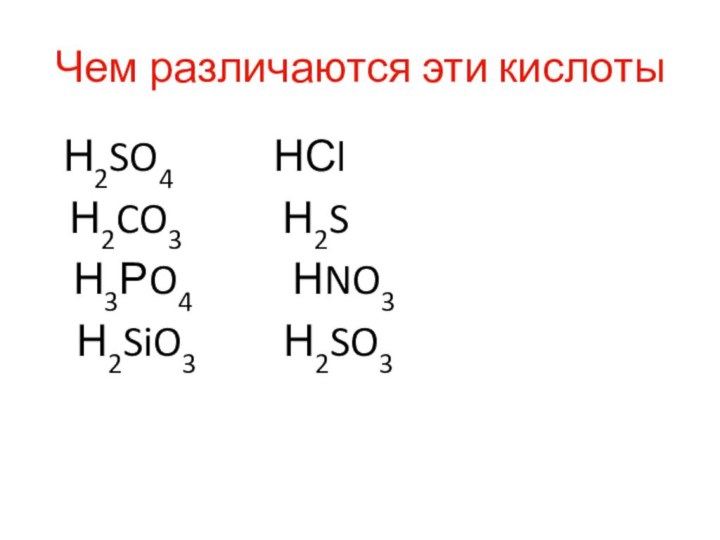
Cu(OH)2, HCl HNO3, H2SO4, Ca(OH)2, SO3, Al2O3,
Zn(OH)2.H2SO4 HNO3 HCl
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть













H2SO4 HNO3 HCl
H3РO4
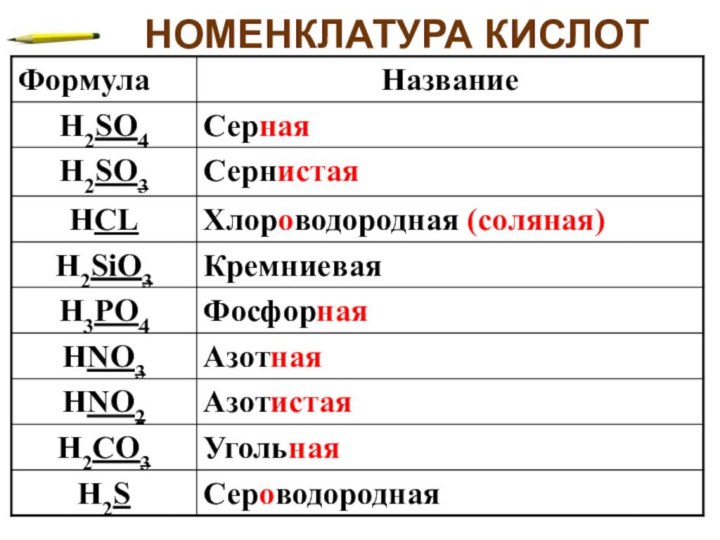
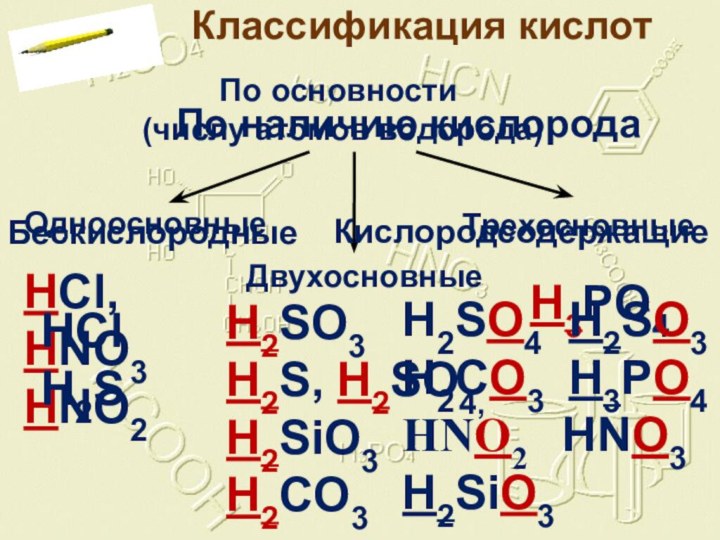
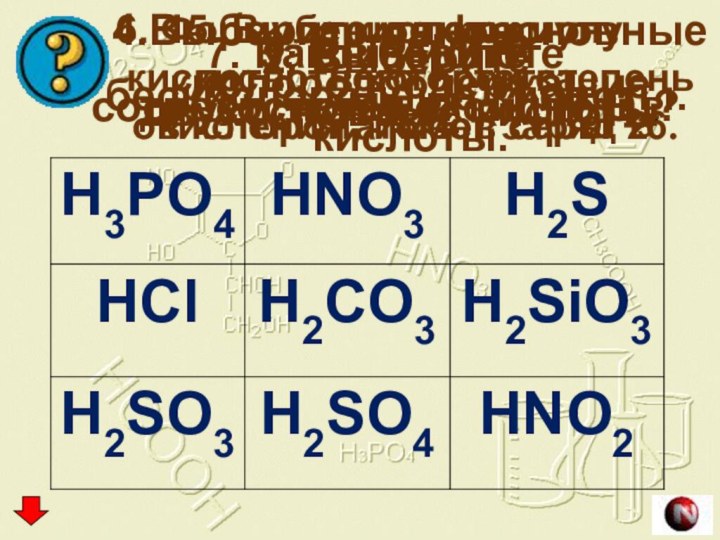
По наличию кислорода
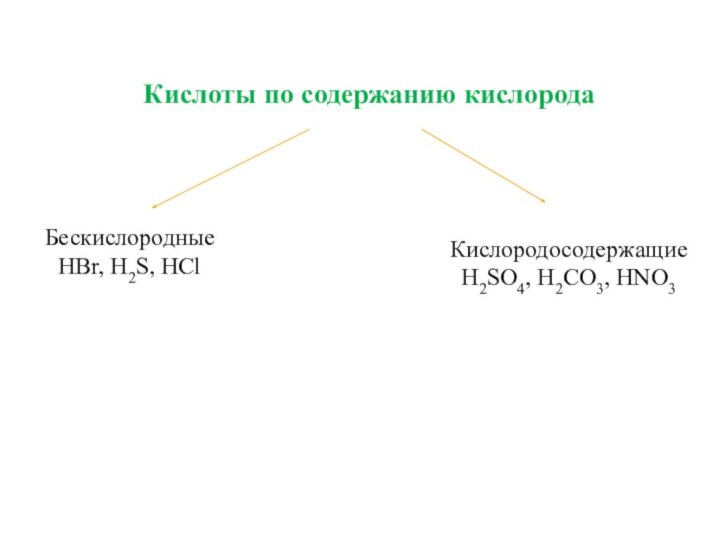
Бескислородные
Кислородсодержащие
HCl
H2S
H2SO4 H2SO3
H2CO3 H3РO4
HNO2 HNO3
H2SiO3
6. Формула кислоты,ион кислотного остатка
в которой, имеет заряд 2-
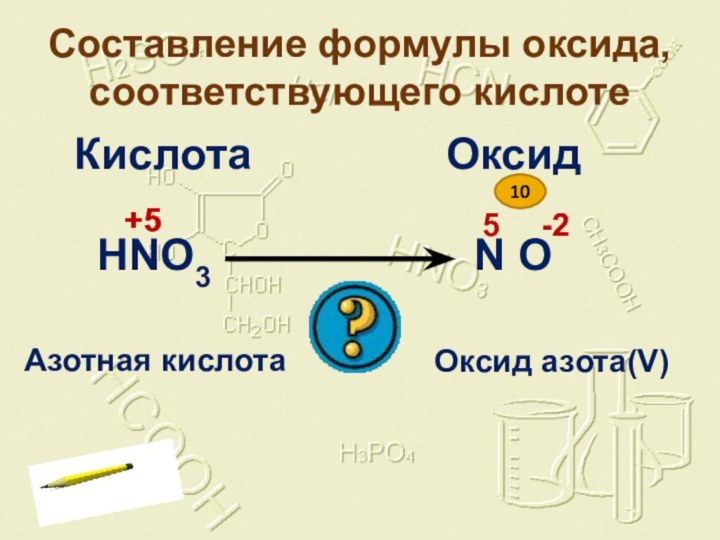
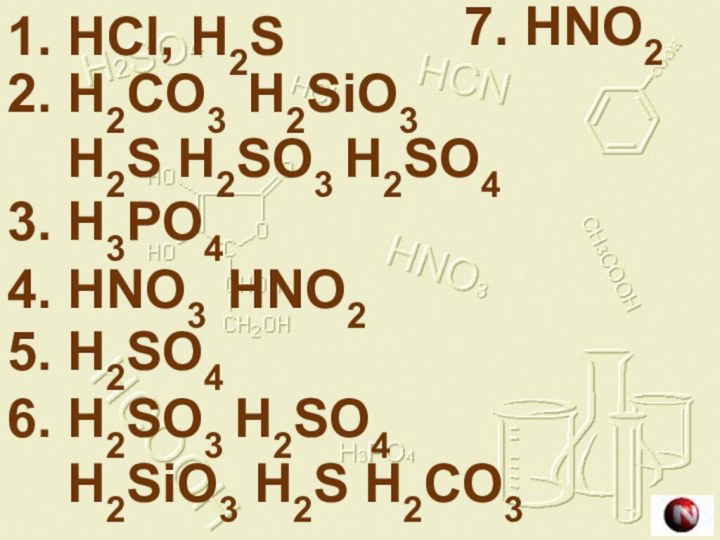
7. Какой кислоте соответствует оксид N2O3?
7. HNO2
Юные химики, помните:
кислоту добавляют в воду, а не наоборот
Такая же судьба грозит
и Тадж-Махалу –
шедевру индийской архитектуры
периода Великих моголов,
в Лондоне - Тауэру и
Вестминстерскому
аббатству…
Жуйте лимон, если горло болит
Сок чудотворный вас исцелит.
Думаю, чо не приукрашу,
Если хвалить буду я простоквашу.
Есть в ней молочная кисла –
Молодость ваша и красота.