- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Химическое равновесие
Содержание
- 2. Скорость реакции Закономерности протекания химических реакций
- 3. Под скоростью химической реакции понимают
- 4. Скорость реакцииНеэффективная ориентацияЭффективная ориентация N2 O2 N2 O2
- 5. Энергетическая диаграмма реакции
- 6. Энергетическая диаграмма реакции-H EactЭнергияАктивированный комплекс
- 7. Скорость реакцииДля гомогенных реакций: ΔС= С2- С1 [моль/л]Δτ= τ2- τ1 [с; мин; ч]
- 8. Скорость реакции
- 10. Скорость реакции Для гетерогенных реакций:Δn= n2- n1
- 11. 1) Природы реагирующих веществ2) Концентрации веществ3) Давления4)
- 12. Зависимость скорости от природы веществ I.
- 13. Зависимость скорости от природы веществб) Характер связи
- 14. Зависимость скорости от природы веществ
- 15. Зависимость скорости от природы веществв)Активность металла (строение
- 16. Зависимость скорости реакции от природы реагирующих веществ
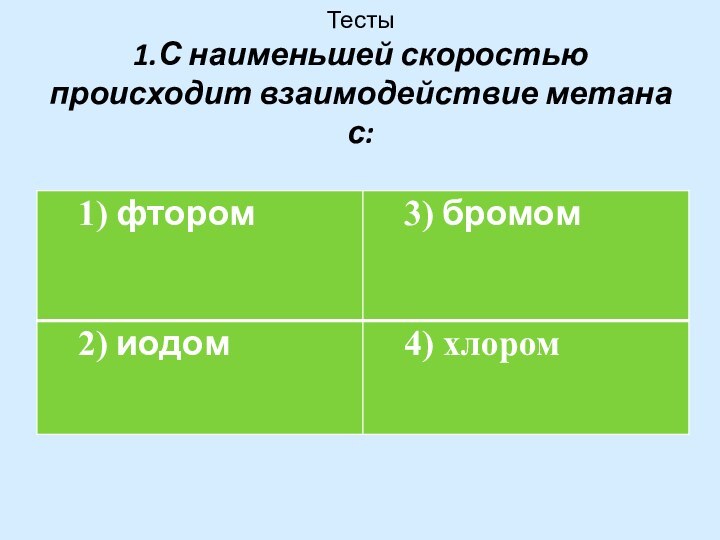
- 17. . Тесты 1.С наименьшей скоростью происходит взаимодействие метана с:
- 18. Тесты 2.С наибольшей скоростью при комнатной температуре протекает реакция между:
- 19. Закон действующих масс II. Влияние концентрации на
- 20. Влияние концентрации на скорость реакции
- 21. Закон действующих масс Математически зависимость
- 22. Слева направо: Гульдберг, Вааге
- 23. Зависимость скорости реакции от концентрации реагентов
- 24. Закон действующих массаА + вВ → сС
- 25. Закон действующих масс В кинетическом уравнении
- 26. Зависимость скорости реакции от площади соприкосновения реагирующих веществ
- 29. Константа равновесия Запишем кинетические уравнения для обратимой
- 30. Обратимая реакция
- 31. Константа равновесия В момент равновесия
- 32. Константа равновесия
- 33. III. Зависимость скорости от давления
- 34. Зависимость скорости от давления
- 35. При повышении температуры на
- 36. Зависимость скорости реакции от температуры
- 37. Вант-Гофф
- 38. Зависимость скорости реакции от температуры vt1 и
- 39. Справа: Вант-Гофф
- 40. Тесты 5. При увеличении температуры от 10
- 41. V. Влияние катализатора на скорость химической реакции
- 42. Влияние катализатора на скорость реакцииКатализПоложительный катализ -
- 43. Влияние катализатора на скорость реакцииКатализ (по фазовому
- 44. Prentice Hall © 2003Chapter 14Гетерогенный катализ
- 45. Гетерогенный катализ
- 47. Ферментативный катализ
- 48. Тесты 6. На скорость химической реакции
- 49. Тесты 7. Уменьшение скорости синтеза аммиака произойдет, если:
- 50. Химическое равновесие. Смещение химического равновесия . Принцип Ле-Шателье
- 51. Химические реакции можно
- 52. Химическое равновесие Обратимые реакции
- 53. Химическое равновесие Химическое равновесие
- 54. Переход системы из одного равновесного состояния в другое называют смещением, или сдвигом положения равновесия.
- 55. Направление сдвига химического равновесия в результате изменения
- 56. Анри Луи Ле Шателье (1850-1936). Французский физико-химик
- 57. Факторы, влияющие на смещение химического равновесия:концентрация реагентовтемпературадавление
- 58. I. Влияние изменения концентрации веществ на смещение
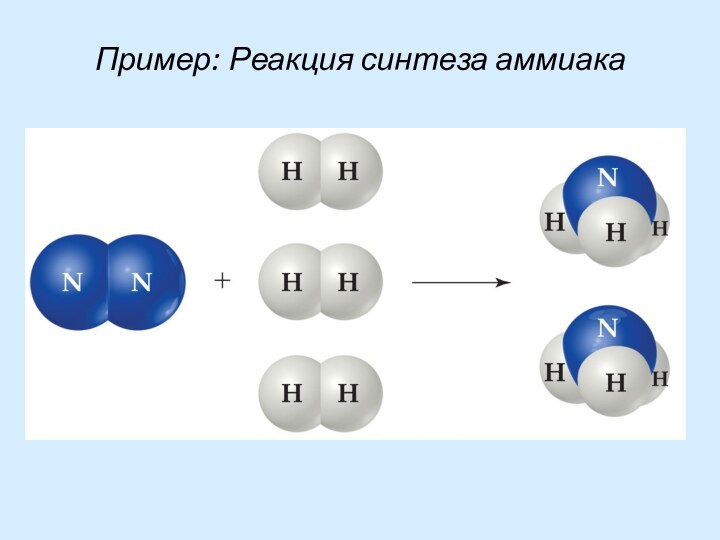
- 59. Пример: Реакция синтеза аммиака
- 60. Повышение концентрации азота увеличивает концентрацию аммиака
- 62. II. Влияние изменения температуры на смещение химического
- 63. Смещение химического равновесия
- 64. III. Влияние давления на химическое равновесие
- 65. Смещение химического равновесия
- 68. IV. Влияние катализатора на химическое равновесиеКатализатор одновременно
- 69. Например: Чтобы сместить равновесие вправо
- 70. Смещение химического равновесияN2 (г) + 3Н2 (г)
- 71. 1. При комнатной температуре с наибольшей скоростью происходит химическая реакция между водой и:Тесты
- 72. Тесты2. С наибольшей скоростью с кислородом при комнатной температуре реагирует:
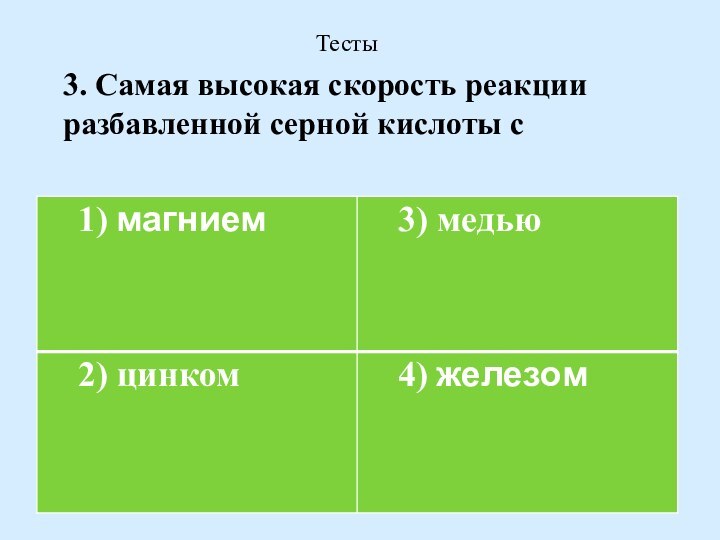
- 73. 3. Самая высокая скорость реакции разбавленной серной кислоты сТесты
- 74. 4. Какой из факторов не оказывает влияния на скорость химической реакции в растворах?Тесты
- 75. 5. Самая высокая скорость реакции разбавленной серной кислоты с:Тесты
- 76. 6. При комнатной температуре с наибольшей скоростью протекает реакция между:Тесты
- 77. 7. Взаимодействие какой пары веществ будет протекать с большей скоростью:Тесты
- 78. 8. Зависимость скорости химической реакции от концентрации реагирующих веществ в наибольшей мере справедлива для реакций, протекающих:Тесты
- 79. 9. На скорость химической реакции2NH3(г) ↔ N2(г) + 3H2(г)не влияет изменение: Тесты
- 80. Тесты10. При увеличении температуры на каждые 10° скорость большинства реакций:
- 81. Тесты11. Если температурный коэффициент химической реакции равен 2, тогда при повышении температуры от 20°С до 50°С скорость реакции:
- 82. Тесты12. На скорость химической реакции между раствором серной кислоты и железом не оказывает влияния:
- 83. Тесты 13. С наименьшей скоростью протекает реакция между:
- 84. Тесты14. Как повлияет на скорость элементарной реакции
- 85. Тесты15. Согласно термохимическому уравнению2NО + О2 ↔ 2NО2 + 113,7 кДжпри образовании 1 моль NО2:
- 86. Тесты 16. Согласно термохимическому уравнению3Fe3О4(к)+ 8Аl(к) =
- 87. Тесты17. В реакции CO(г) + 2H2(г) ↔
- 88. Тесты18. Реакция, в которой повышение давления вызовет смещение равновесия вправо, - это:
- 89. Скачать презентацию
- 90. Похожие презентации






![Химическое равновесие Скорость реакцииДля гомогенных реакций: ΔС= С2- С1 [моль/л]Δτ= τ2- τ1 [с; мин; ч]](/img/tmb/14/1323999/81a1173ea5ad01dd482b451257c463da-720x.jpg)


![Химическое равновесие Скорость реакции Для гетерогенных реакций:Δn= n2- n1 [моль]](/img/tmb/14/1323999/5da4b271baf270503fd6a5b108af1697-720x.jpg)












































































Слайд 3 Под скоростью химической реакции понимают число
элементарных взаимодействий, происходящих в единицу времени в единице объема
системы (для гомогенных реакций) или на единице поверхности раздела фаз (для гетерогенных реакций).Скорость реакции
Слайд 10
Скорость реакции
Для гетерогенных реакций:
Δn= n2- n1 [моль]
Δτ= τ2- τ1 [с;
мин; ч]S - [м2]
Слайд 11
1) Природы реагирующих веществ
2) Концентрации веществ
3) Давления
4) Температуры
5)
Наличия катализатора или ингибитора
Скорость химической реакции зависит от ряда
факторов:Слайд 12 Зависимость скорости от природы веществ I. Влияние природы
реагирующих веществ рассматривают с разных позиций:
а) Фазовое состояние веществ-реагентов
Ва(ОН)2(р-р)
+ Н2SO4(р-р) → BaSO4↓+ 2Н2О – быстрееС(тв) + О2(г) = СО2 – медленнее
Особенно быстро идет процесс в сторону связывания ионов в нерастворимый, газообразный продукт или слабый электролит при взаимодействии растворов сильных электролитов (реакция нейтрализации, осаждения).
Гомогенные реакции протекают быстрее гетерогенных:
Слайд 13
Зависимость скорости от природы веществ
б) Характер связи в
реагентах
AgNO3 + KCl = AgCl↓ + KNO3 - мгновенно
H2
+ I2 ↔ 2HI – медленно Быстрее всего протекают реакции
между веществами с ионной связью, медленнее – с неполярной
ковалентной:
Слайд 15
Зависимость скорости от природы веществ
в)Активность металла (строение атома)
2Na + 2H2O = 2NaOH + H2
– медленнее2K + 2H2O = 2KOH + H2 – быстрее (калий более активный металл)
Чем активнее металл, тем выше скорость
реакции:
Слайд 19
Закон действующих масс
II. Влияние концентрации на скорость реакции
Новые вещества образуются в результате соударения
(сталкивания) частиц исходных веществ. Чем больше исходных частиц в единице объема, то есть чем больше концентрация, тем выше скорость реакции.
Слайд 21
Закон действующих масс
Математически зависимость скорости
от концентрации выражается основным законом кинетики - законом действующих
масс (Гульдберг, Вааге):При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ, взятых в степени соответствующих стехиометрических коэффициентов.
Слайд 24
Закон действующих масс
аА + вВ → сС +
dD
Кинетическое уравнение реакции имеет вид:
где:
V - скорость реакции;
K -
константа скорости реакции, зависит от природы реагирующих веществ и температуры;C(A) и C(B)-концентрации реагирующих в-в жидкой и газовой фаз [моль/л].
V = k · Ca(A) · Cb(B)
Слайд 25
Закон действующих масс
В кинетическом уравнении реакции
не учитывается концентрация веществ твердой фазы, т.к. в этом
случае реакция идет на ее поверхности.Для этого реагенты измельчают.
Чем больше поверхность твердой фазы реагента, тем выше скорость реакции.
Слайд 27
Тесты 3. Во сколько раз изменится
скорость элементарной реакции 2А + В = А2В, если концентрацию вещества А уменьшить в 2 раза?Слайд 28
Тесты 4. Реакция протекает по уравнению N2 + 3Н2↔ 2NH3. Как изменится скорость реакции, если концентрацию азота увеличить в 4 раза, а концентрацию водорода — в 2 раза?
Слайд 29
Константа равновесия
Запишем кинетические уравнения для обратимой реакции:
аА
+ вВ ↔ сС + dD
V1 =
k1 Ca(A) · Cb(B)V2 = k2 Cc(C) · Cd(D)
V1 – скорость прямой реакции
V2 – скорость обратной реакции
k1, k2 – константы скорости реакции
Слайд 31
Константа равновесия
В момент равновесия реакции
учитываются равновесные концентрации веществ :
V1 = k1 [А]a ·
[В]bV2 = k2 [С]c · [D]d ,
где [ ] – равновесные концентрации.
В момент равновесия скорость прямой реакции равна скорости обратной реакции
V1 = V2
Слайд 33
III. Зависимость скорости от давления
Давление
практически не влияет на скорость реакции с участием веществ
твердых и жидких.Эта зависимость подчиняется кинетическому уравнению реакции.
Для газов с увеличением давления возрастает концентрация веществ газовой фазы, а значит увеличивается скорость реакции.
Слайд 35 При повышении температуры на каждые
10°С скорость большинства химических реакций возрастает в 2-4 раза.
IV.
Зависимость скорости реакции от температурыОпределяется правилом Вант-Гоффа:
Слайд 38
Зависимость скорости реакции от температуры
vt1 и vt2
и — скорости реакций при начальной (t1) и конечной
(t2 ) температуре;γ — коэффициент скорости реакции, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10°С .
Слайд 40 Тесты 5. При увеличении температуры от 10 до 30°С
скорость реакции, температурный коэффициент которой равен 3:
Слайд 41
V. Влияние катализатора на скорость химической реакции
Катализаторы - специфические вещества, которые влияют на скорость реакции,
участвуют в реакции, но к концу реакции качественно и количественно сохраняются. Катализ - явление изменения скорости реакции в присутствии подобных веществ.
Слайд 42
Влияние катализатора на скорость реакции
Катализ
Положительный катализ - увеличение
скорости реакции в присутствии катализатора.
Отрицательный катализ - снижение скорости
реакции в присутствии ингибитора.
Слайд 43
Влияние катализатора на скорость реакции
Катализ (по фазовому состоянию)
Гомогенный
катализ - реакция протекает во всём объёме системы. При
этом катализатор и реагенты находятся в одной фазе.Гетерогенный катализ - реакция протекает на поверхности твёрдого катализатора. При этом катализатор и реагирующие вещества находятся в разных фазах.
Слайд 48 Тесты 6. На скорость химической реакции Zn + СuСl2
= ZnCl2 + Сu
не оказывает влияния увеличение:
Слайд 51
Химические реакции можно разделить
на две группы: необратимые и обратимые.
Необратимые реакции
идут только в одном направлении и завершаются полным превращением исходных веществ в конечные продукты.Например,
2КClO3 = 2КСl + 3О2
Химическое равновесие
Слайд 52
Химическое равновесие
Обратимые реакции одновременно протекают в двух
взаимно противоположных направлениях.
Например,
Н2 + I2 ↔2HI
Слайд 53
Химическое равновесие
Химическое равновесие — это
состояние системы, при котором скорость прямой реакции v1 равна
скорости обратной реакции v2Слайд 54 Переход системы из одного равновесного состояния в другое
называют смещением, или сдвигом положения равновесия.
Слайд 55 Направление сдвига химического равновесия в результате изменения внешних
условий определяется принципом подвижного равновесия, или принципом Ле-Шателье, Брауна:
Если на систему, находящуюся в равновесии, производится какое-либо
внешнее воздействие (изменяются концентрация, температура, давление), то это воздействие благоприятствует протеканию той из двух противоположных реакций, которая ослабляет произведенное воздействие.
Слайд 57
Факторы, влияющие на смещение химического равновесия:
концентрация
реагентов
температура
давление
Слайд 58 I. Влияние изменения концентрации веществ на смещение химического
равновесия
А + В ↔ С +
Dа) Увеличение концентрации исходных веществ или уменьшение концентрации продуктов смещает равновесие
вправо→ [А]↑; [В]↑; [С]↓; [D]↓
б) Увеличение концентрации продуктов реакции или уменьшении концентрации исходных веществ смещает равновесие влево ← [С]↑; [D]↑; [А]↓; [В]↓
При этом не учитывают вещества в твердом агрегатном состоянии
Слайд 62
II. Влияние изменения температуры на смещение химического равновесия
Анализ
производится с учетом теплового эффекта реакции (Q)
а) Повышение температуры
смещает равновесие в сторону эндотермической реакции (-Q)б) Понижение температуры – в сторону экзотермической (+Q)
Слайд 64
III. Влияние давления на химическое равновесие
Имеет место только в случае участия в реакции
газообразных веществ.а) Увеличения давления смещает равновесие в сторону меньшего числа частиц газа (меньшего объема системы)
б) Уменьшение давления смещает равновесие в сторону большего числа частиц газа (большего объема системы)
в) В случае равного числа частиц газа слева и справа давление не оказывает влияния на смещение равновесия.
Слайд 68
IV. Влияние катализатора на химическое равновесие
Катализатор одновременно равно
увеличивает скорость прямой и обратной реакций и не влияет
на смещение химического равновесия.
Слайд 69
Например: Чтобы сместить равновесие вправо в
реакции синтеза аммиака:
N2 (г) + 3Н2 (г) ↔
2NН3 (г) + Q,т.е. увеличить выход аммиака необходимо:
1) Повысить концентрацию N2 и Н2;
2) Понизить концентрацию NН3 – отводить продукт из сферы реакции.
3) Понизить температуру, т.к. прямая реакция экзотермическая + Q
4) Повысить давление, т.к. в ходе реакции уменьшается объем системы:
4V газа ↔ 2Vгаза.
Смещение химического равновесия
Слайд 70
Смещение химического равновесия
N2 (г) + 3Н2 (г) ↔
2NН3 (г) + Q
Чтобы сместить равновесие влево необходимо:
1) Понизить
концентрацию N2 и Н2 2) Повысить концентрацию NН3
3) Повысить температуру, т.к. обратная реакция эндотермическая -Q
4) Понизить давление, т.к. в ходе обратного процесса увеличивается объем системы.




























