Слайд 2
Домашнее задание
Зад.2 ст.78
Ва(NO3)2 +H2SO4 = ВаSO4 +2HNO3
Na2SO3+H2SO4= Na2SO4
+H2O + SO2
MgCl2 + 2H2SO4кон = Mg(HSO4)2 + 2НСl
2NaOH+
H2SO4 = Na2SO4 +2H2O
2Al(OH)3 + 3H2SO4= Al2(SO4)3 +3H2O
Слайд 3
Выберите, с какими из перечисленных веществ реагирует разбавленная
серная кислота:
серебро,
алюминий,
оксид марганца (II), оксид марганца (VII),
гидроксид калия, сульфид железа(II), нитрат магния, нитрат бария, карбонат калия.
Составьте уравнения возможных реакций в молекулярном и ионном виде.
Слайд 4
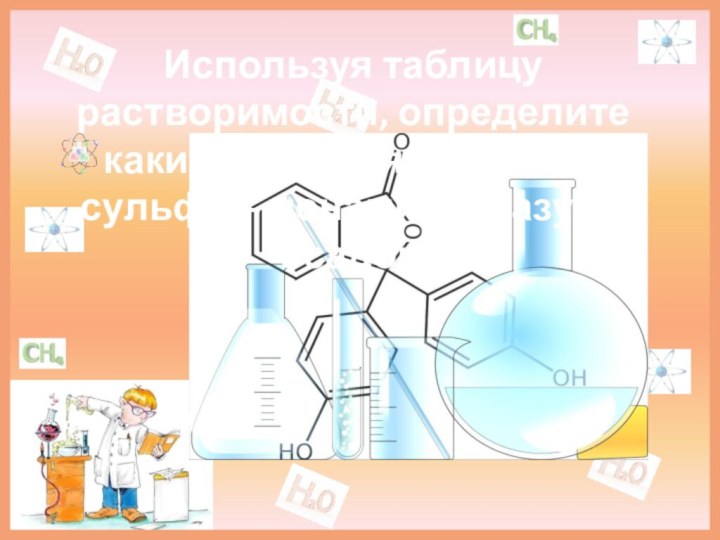
Используя таблицу растворимости, определите какие ионы связываясь с
сульфат- ионами, образуют осадок.
Слайд 5
Едва ли найдётся другое, искусственно добываемое,
вещество, столь часто применяемое в технике, как серная кислота.
Там, где техническая деятельность развита, там потребляется и много серной кислоты.
Д. И. Менделеев
Слайд 7
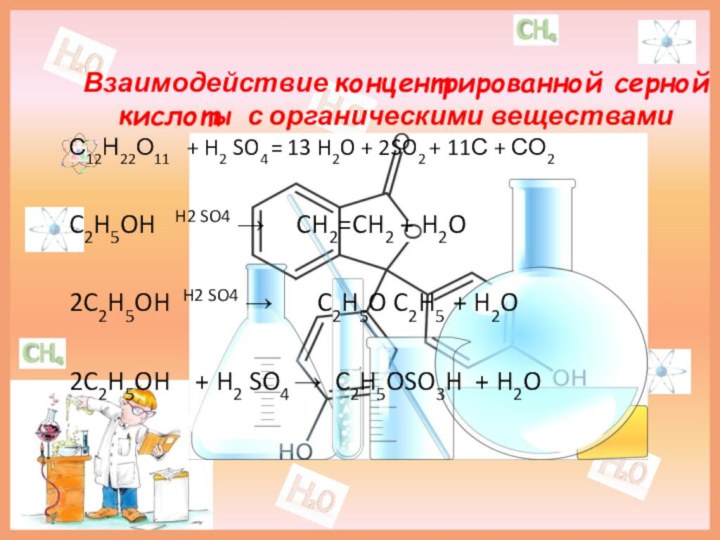
Взаимодействие концентрированной серной кислоты с органическими веществами
С12Н22О11
+ H2 SO4 = 13 H2O + 2SO2
+ 11С + СО2
C2H5OH H2 SO4 → CH2=CH2 + H2O
2C2H5OH H2 SO4 → C2H5O C2H5 + H2O
2C2H5OH + H2 SO4 → C2H5OSO3H + H2O
Слайд 8
Концентрированная серная кислота – сильный окислитель
Взаимодействие с металлами
Слайд 9
Концентрированная серная кислота не реагирует
с благородными металлами
и пассивирует Fe, Cr, Ni, Al!
Благородные металлы:
золото,
серебро платина,
родий, иридий, палладий,
рутений, Осмий.
Слайд 10
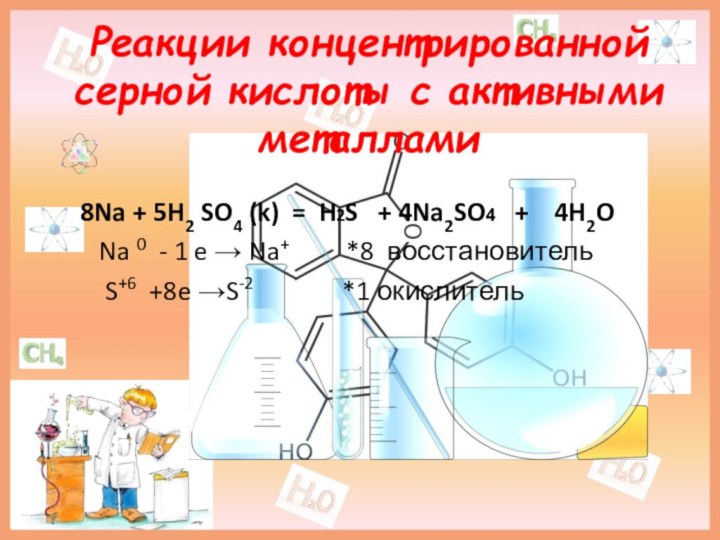
Реакции концентрированной серной кислоты с активными металлами
8Na +
5H2 SO4 (k) = H2S + 4Na2SO4
+ 4H2O
Na 0 - 1 e → Na+ *8 восстановитель
S+6 +8e →S-2 *1 окислитель
Слайд 11
Реакции концентрированной серной кислоты с металлами средней активности
..Zn
+ ..H2 SO4 = .. ZnSO4 + ..H2O
+ ..SO2
..Zn + ..H2 SO4 = ..ZnSO4 + ..H2O + ..H2S
…Zn + …H2 SO4 = …ZnSO4 + …H2O +… S
Слайд 12
Реакции концентрированной серной кислоты с алюминием и железом
На
холоде концентрированная серная кислота пассивирует многие металлы, в том
числе РЬ, Cr, Ni, сталь, чугун. При нагревании реакционной смеси происходит химическая реакция:
..Al+...H2SO4 =.. Al2(SO4)3+..H2S↑ +…H2O
Слайд 13
Реакции концентрированной серной кислоты с малоактивными металлами
…Cu +
…H2 SO4 =… CuSO4 + …H2O + …SO2
Слайд 14
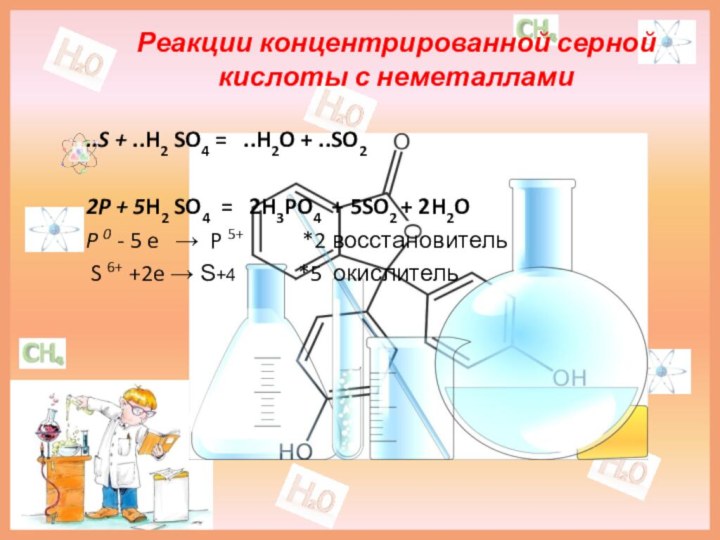
Реакции концентрированной серной кислоты с неметаллами
..S + ..H2
SO4 = ..H2O + ..SO2
2P + 5H2 SO4
= 2H3PO4 + 5SO2 + 2H2O
P 0 - 5 e → P 5+ *2 восстановитель
S 6+ +2e → S+4 *5 окислитель
Слайд 15
Рефлексия
Что нового вы узнали о серной кислоте?
Вы открыли
склянку с вязкой бесцветной жидкостью и увидели выделяющийся из
нее белый дым. Когда в склянку опустили лучину, то ее конец обуглился. Какое вещество находиться в склянке?
Как доказать ?