Слайд 2
Цели урока:
- сформировать понятие об окислительно -восстановительных реакциях;
-
научить учащихся составлять уравнения ОВР методом электронного баланса
Задачи урока:
-
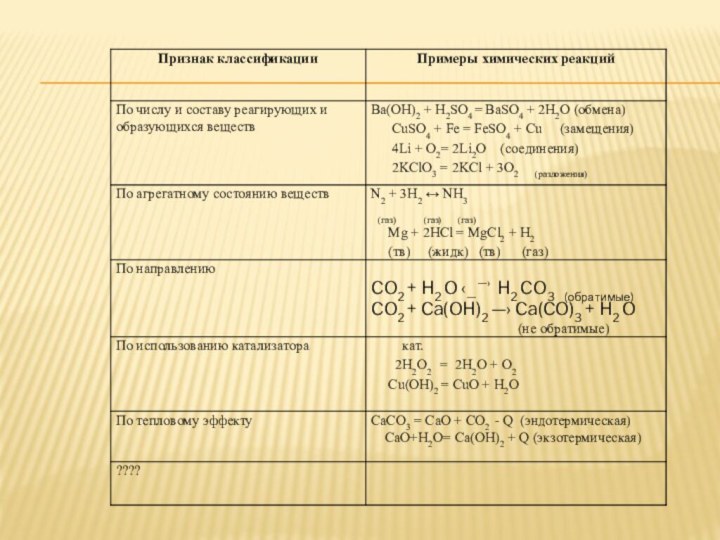
повторить известные признаки классификации химических реакций;
- повторить правила расчета степеней окисления в соединениях;
- ввести понятия «окислительно -восстановительные реакции», «окисление», «восстановление», «окислитель», «восстановитель»;
- научиться составлять уравнения ОВР методом электронного баланса.
Слайд 6
Что такое степень окисления ?
Степень окисления – условный
заряд элемента, рассчитанный, исходя из условия, что все связи
в соединении ионные.
Степень окисления бывает: положительная, отрицательная, нулевая. Знак ставится перед числом – это с.о., если после числа – то заряд.
Какие правила определения степени атомов химических элементов вы знаете?
Слайд 7
Правила вычисления степени окисления (СО) элементов:
Степень окисления кислорода
в соединениях равна –2
H+12O -2 Na 2+1 O -2
(исключение: Н2 +1 O2 -1 пероксид водорода)
- Водород в соединениях имеет степень окисления +1
( исключение: с металлами -1 Na 1+H1-)
- Металлы в соединениях имеют +СО
Ca2+O2- , Zn2+CL2-
- Степень окисления элементов простых веществ равна 0
H2 0 , I2 0 , Ca0
Степень окисления фтора -1
H +1F -1 , O +2 F-1
Для элементов главных подгрупп (А) ПСХЭ Д.И. Менделеева
Высшая СО (+) = № гр
Низшая СО (-) = № гр - 8
- В сложном веществе алгебраическая сумма СО всех атомов ( с учетом индексов) равна нулю, а сложном ионе – его заряду
Например:
+1 Х -2
H2SO4
+1*2+x-8=0
x=6
H+1 N+5 O3 -2 (S+6 O4 -2 ) -2
(+1) •1 + (+5) •1+(-2)•3=0 (+6) •1 + (-2) •4= -2
Слайд 8
Выполните задание 1.
Определите степени окисления атомов химических
элементов по формулам их соединений:
H2S, O2, NH3, HNO3,
Fe, K2Cr2O7
Слайд 9
Выполните самопроверку
+1 -2
0 -3 +1 +1 +5 -2
H2S O2 NH3 HNO3
0 +1 +7 -2
Fe K2Cr2O7
Слайд 10
Выполните задание 2
Определите, что происходит со степенью окисления
серы при следующих переходах:
А) H2S → SO2 → SO3
Б)
SO2→ H2SO3 → Na2SO3
Какой можно сделать вывод после выполнения второй генетической цепочки?
На какие группы можно классифицировать химические реакции по изменения степени окисления атомов химических элементов?
Слайд 11
Проверяем
А) H2S-2 → S+4 O2 → S+6 O3
Б)
S+4 O2→ H2S+4 O3 → Na2S+4O3
В первой цепочке превращений
сера повышает свою СО от (-2) до (+6).
Во второй цепочке степень окисления серы не меняется.
Слайд 12
Есть еще одна классификация, основанная на изменении или
сохранении степеней окисления атомов химических элементов, образующих реагенты и
продукты реакции.
По этому признаку различают реакции:
Слайд 13
Пример:
2Cu0 + O2 =2 Cu2+O2-
2H+CL- + Zn0 =
Zn2+CL2- + H20
Реакции, протекающие с изменением степеней окисления атомов
всех или некоторых элементов, входящих в состав реагирующих веществ, называют окислительно-восстановительными.
Слайд 14
Запишем определение
Окислительно-восстановительные реакции (ОВР) – реакции, которые протекают
с изменением степени окисления атомов, входящих в состав реагирующих
Слайд 15
Задание № 3.
К окислительно-восстановительным
реакциям не относится реакция,
представленная схемой:
А) N2 + 3Н2 = 2NН3
Б) Mg
+ 2HCl = MgCl2 + H2↑
В)MgCO3 = MgO + CO2 ↑
Г) 2CuO = 2Cu + O2↑
Слайд 16
Задание № 4.
К окислительно- восстановительным
реакциям относится реакция,
представленная
схемой:
А) H2O + CaO = Ca(OH)2
Б) H2O +
N2O5 = 2HNO3
В) Na2CO3 + 2HCl = 2NaCl + H2O + CO2
Г) CuO + H2 = Cu + H2O
Слайд 17
Почему эти реакции так называются?
Пример:
H2SO4 + Mg =MgSO4+H2
Расставляем
коэффициенты:
H2 +1 S +6O4 -2 + Mg 0 =
Mg +2 S +6O4 -2 +H2 0
Слайд 18
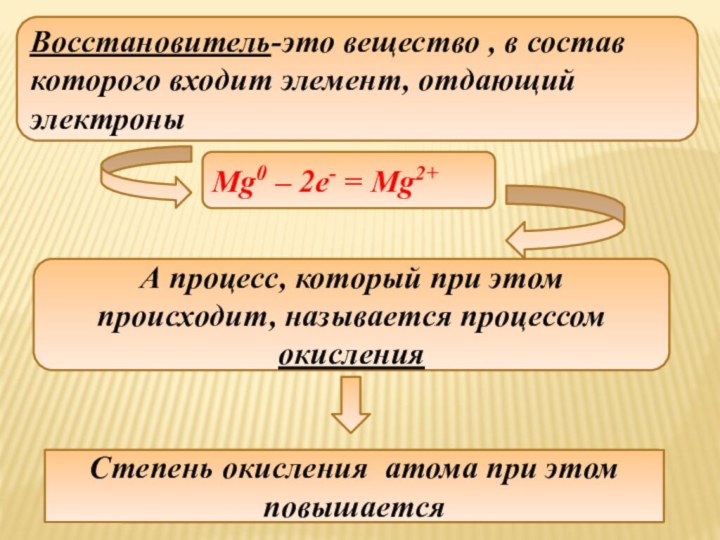
Восстановитель-это вещество , в состав которого входит элемент,
отдающий электроны
Mg0 – 2e- = Mg2+
А процесс, который при
этом происходит, называется процессом окисления
Степень окисления атома при этом повышается
Слайд 19
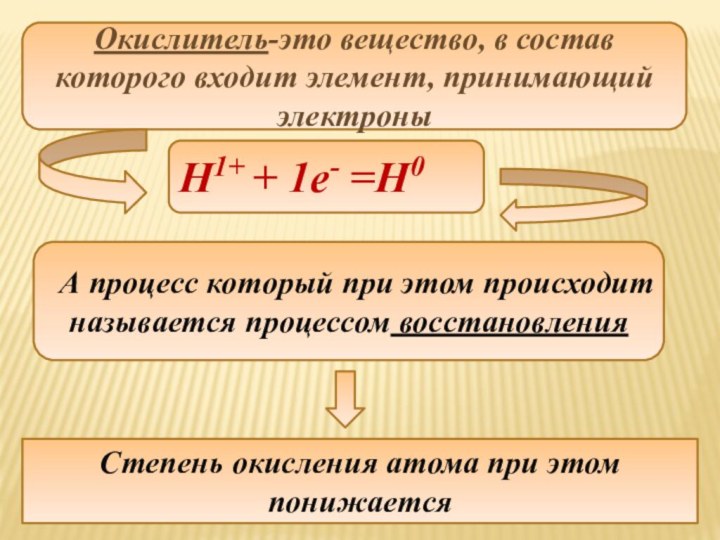
Окислитель-это вещество, в состав которого входит элемент, принимающий
электроны
Н1+ + 1e- =Н0
А процесс который при этом
происходит называется процессом восстановления
Степень окисления атома при этом понижается
Слайд 21
Окисление – процесс отдачи электронов атомом.
Окислитель – атом,
принимающий электроны и понижающий свою степень окисления, в процессе
реакции – восстанавливается.
Восстановитель – атом, отдающий электроны и повышающий свою степень окисления, в процессе реакции – окисляется.
Восстановление – процесс принятия электронов атомом.
Запишем определения
Слайд 22
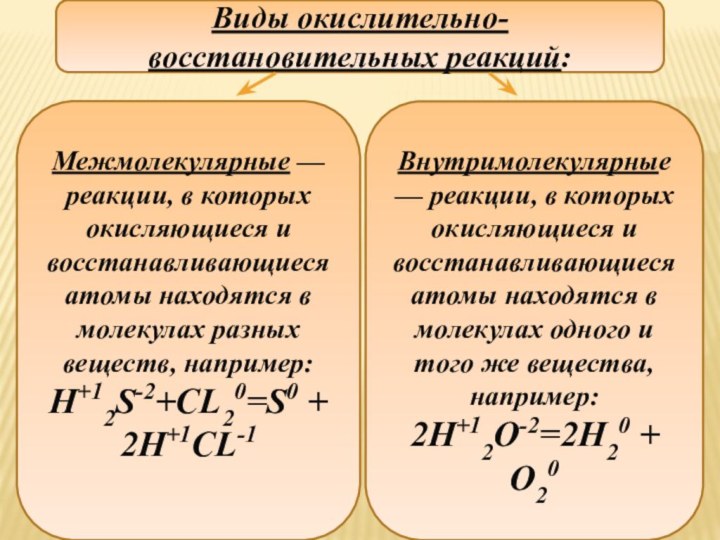
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы
находятся в молекулах разных веществ, например:
H+12S-2+CL20=S0 + 2H+1CL-1
Виды окислительно-восстановительных
реакций:
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H+12O-2=2H20 + O20
Слайд 23
Задание 5
Упражнения для закрепления материала
- Процесс отдачи
электронов – это …...
- Атомы, ионы или молекулы, принимающие
электроны, - это… .
-Процесс принятия электронов – это … .
- Алюминий в реакции:
3H 2SO4 + 2Al = Al2 (SO4)3 + 3H2↑
- является …
- Хлор в реакции:
2Fe + 3Cl2 = 2FeCl3
- является… .
Слайд 24
Проверяем:
Упражнения для закрепления материала
Процесс отдачи электронов –
это … (процесс окисления).
Атомы, ионы или молекулы, принимающие электроны,
- это… (окислители).
Процесс принятия электронов – это … (процесс восстановления).
Алюминий в реакции
3H2SO4 + 2Al = Al2(SO4)3 + 3H2↑
является … (восстановителем).
Хлор в реакции
2Fe + 3Cl2 = 2FeCl3
является… (окислителем).
Слайд 25
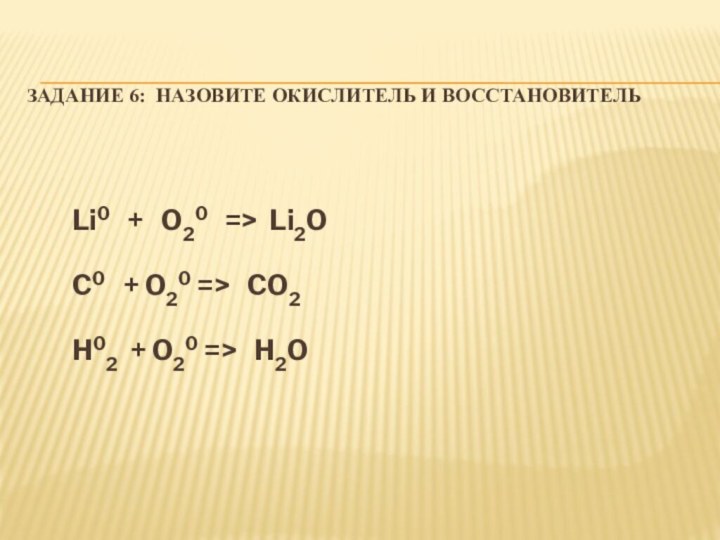
Задание 6: Назовите окислитель и восстановитель
Li0
+ O20 => Li2O
C0 +
O20 => CO2
H02 + O20 => H2O
Слайд 26
Задание 7: Дополните схемы. Укажите роль частицы и название
процесса.
Образец:
S0→S-2. Окислитель / S0+2e →S-2 /
восстановление
С0 → С+2
H20 →2H+1
Mg+2→ Mg0
Al0→ Al+3
F20→ 2F-1
Слайд 27
Алгоритм составления
окислительно-восстановительных реакций
а) составляем химическое уравнение:
Al + H2SO4 = Al2(SO4)3 + H2
б) определяем степень окисления всех элементов в формулах веществ в левой и правой стороне уравнения:
Al0 + H2+1SO4 = Al2+3(SO4)3 + H20
в) подчеркиваем знаки элементов, у которых степень окисления изменяется в процессе реакции:
Al0 + H2+1SO4 = Al2+3(SO4)3 + H20
г) составляем схему электронного баланса:
Al0 -3е- = Al+3 3 2 восстановитель окисление
2H+1 +2е- = H20 2 3 окислитель восстановление
д) расставляем коэффициенты:
2Al0 + 3H+2SO4 = Al+32(SO4)3 + 3Н20
е) проверяем , правильно ли расставлены коэффициенты, с учетом общей суммы атомов кислорода.
Слайд 28
Закрепление
Расставьте коэффициенты в УХР
Al2O3 + H2 = H2O
+ Al
методом электронного баланса, укажите процессы окисления (восстановления),
окислитель (восстановитель), выполните самопроверку.
Слайд 29
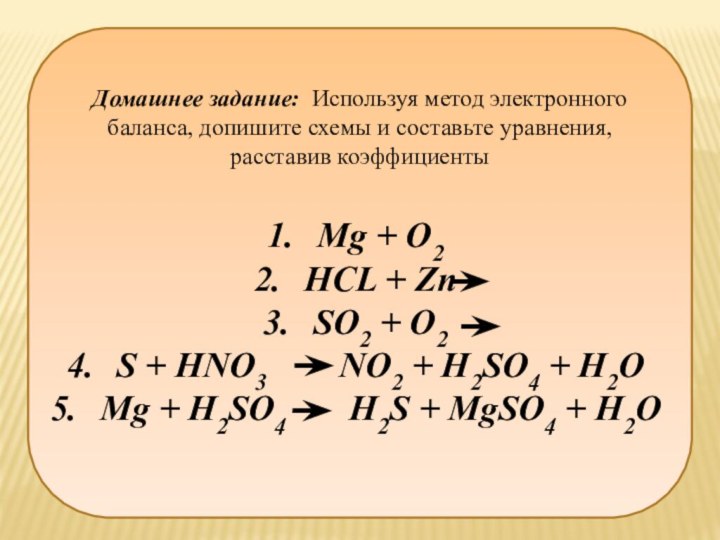
Домашнее задание: Используя метод электронного баланса, допишите схемы
и составьте уравнения,
расставив коэффициенты
Mg + O2
HCL +
Zn
SO2 + O2
S + HNO3 NO2 + H2SO4 + H2O
Mg + H2SO4 H2S + MgSO4 + H2O