- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Кислоты,их классификация и свойства 8 класс (Педагогический дебют)
Содержание
- 2. Пьер Симон Лаплас:То, что мы знаем – ограничено;То, что не знаем – бесконечно.
- 3. ВЗАИМОПРОВЕРКА:1. Вещество с химической формулой Al2O3 относиться к классуа) оснований;б) кислот;в) оксидов;г) солей.
- 4. а) оксид кальция; б) гидроксид кальция; в)
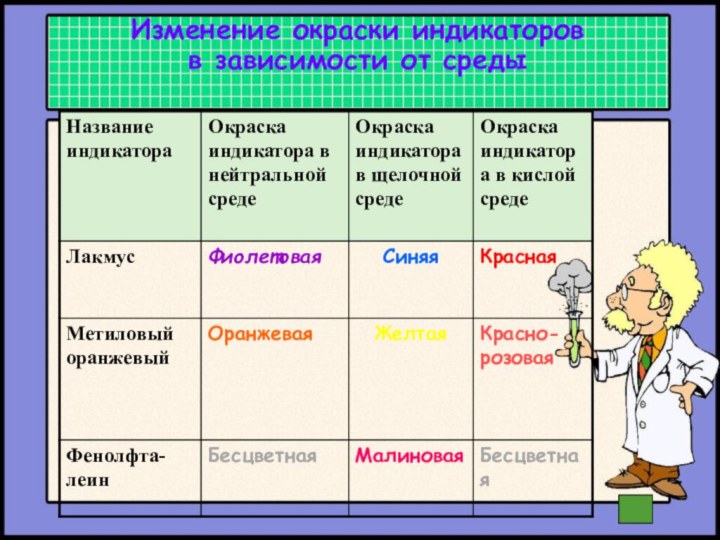
- 5. 3. Индикатор фенолфталеин в щелочной среде становитсяа) бесцветным; б) малиновым; в) красным; г) желтым.
- 6. 4. Формулы только оксидов приведены в ряду
- 7. 5. Распределите приведенные ниже вещества на три
- 8. Критерии оценивания работы:
- 10. Тема урока: Кислоты.
- 11. Наши цели:1) ХОЧУ ЗНАТЬ определение понятия «кислоты»,
- 12. М. В. Ломоносов." Один опыт я ставлю выше, чем тысячу мнений рожденных только воображением."
- 13. Определение понятия «КИСЛОТА»кислоты - это сложные вещества, состоящие из кислотных остатков и водорода.
- 14. Представители кислот: HCl, HNO2, HNO3, H3PO4, H2SO3, H2SO4, H2SiO3, H2CO3, H2S.
- 15. Классификация кислотпо числу атомов водорода:одноосновные (HCl, HNO3).двухосновные
- 16. Третья классификация кислот основана на растворимости веществ
- 17. Запишите в рабочий лист:По числу атомов водородаПо наличию атомов кислородаПо растворимости в водеодноосновные двухосновныетрехосновныекислородсодержащиебескислородныерастворимыенерастворимые
- 18. Кислоты вокруг нас
- 19. Техника безопасности при работе с кислотами:
- 20. Изменение окраски индикаторов в зависимости от среды
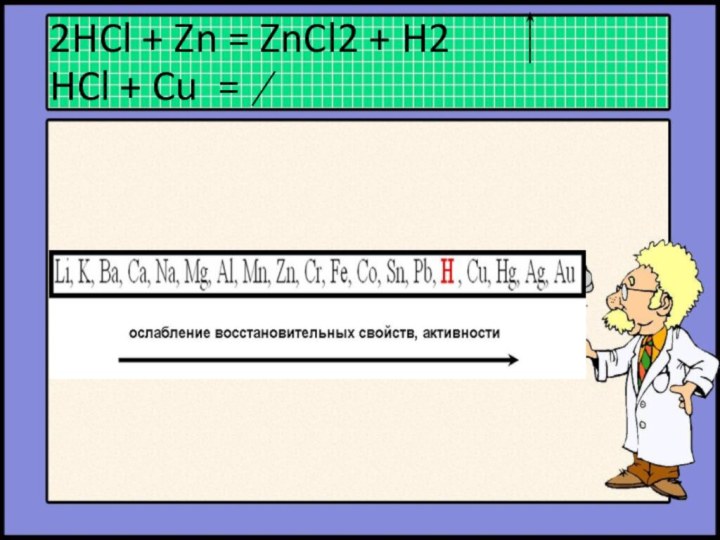
- 21. Химические свойства кислот: 1.Металл + Кислота = Соль + Водород (Реакция замещения)
- 22. 2HCl + Zn = ZnCl2 + H2 HCl + Cu =
- 23. Исключения: 4HNO3(k) + Zn = Zn(NO3)2
- 24. Химические свойства кислот: 2)Соль + Кислота
- 25. Условия протекания: 1) Если выделяется газ:
- 26. Химические свойства кислот: 3) Кислота +
- 27. Химические свойства кислот: 4)Основание + Кислота
- 28. 1) HCl взаимодействует с a) Ca б) Ag в) Au
- 29. 2) При взаимодействии ZnO c HNO3 образуется
- 30. 3) Взаимодействие кислоты с основанием относится к реакциям а) Замещения б) Обмена в) Соединения
- 31. 4)MgSO4 u H2O образуется при взаимодействии
- 32. 5)При внесении лакмусовой бумажки в раствор кислоты
- 33. - Я узнал... - Я научился... -
- 34. Скачать презентацию
- 35. Похожие презентации
Пьер Симон Лаплас:То, что мы знаем – ограничено;То, что не знаем – бесконечно.
































Слайд 3
ВЗАИМОПРОВЕРКА:
1. Вещество с химической формулой Al2O3 относиться к классу
а)
оснований;
б) кислот;
в) оксидов;
г) солей.
Слайд 4 а) оксид кальция; б) гидроксид кальция; в) оксид калия; г) гидроксид
калия.
2. Вещество с химической формулой KOH называется
Слайд 5
3. Индикатор фенолфталеин в щелочной среде становится
а) бесцветным;
б)
малиновым;
в) красным;
г) желтым.
Слайд 6
4. Формулы только оксидов приведены в ряду
а) H2SO4,
СаО, CuCl2 б) Na2CO3, Na2O, N2O5 в) Р2О5, BaO, SO3 г) NaOH,
Na2O, Cu(OH)2Слайд 7 5. Распределите приведенные ниже вещества на три группы.
Оксиды
СаО, СuО, Н2О, Сl2О7
Основания Аl(ОН)3, Fе(ОН)2, NаОН
Кислоты
НСl, НNО3, Н2SО4
Слайд 11
Наши цели:
1) ХОЧУ ЗНАТЬ определение понятия «кислоты», их
состав;
2)ИНТЕРЕСНО УЗНАТЬ о представителях кислот;
3) НАМ НЕОБХОДИМА классификация
кислот;4) ХОЧУ УМЕТЬ распознавать кислоты с помощью индикаторов.





























