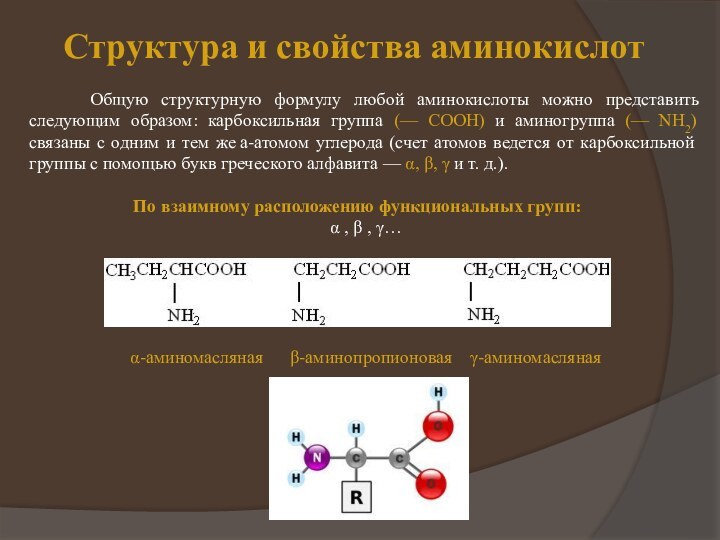
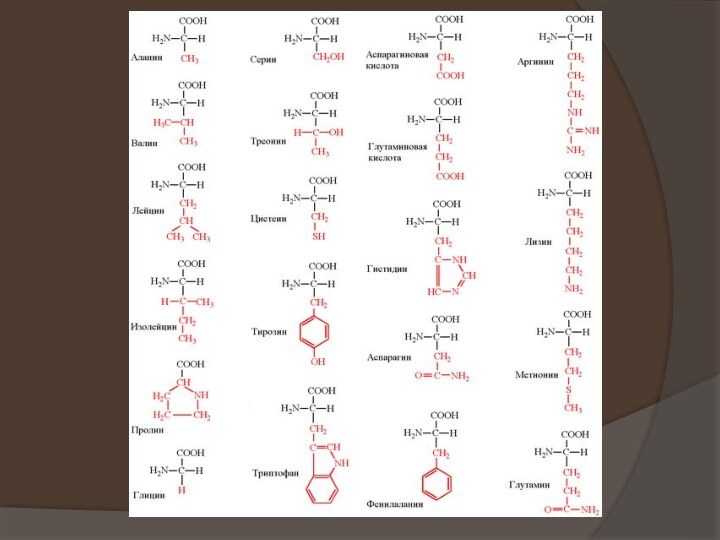
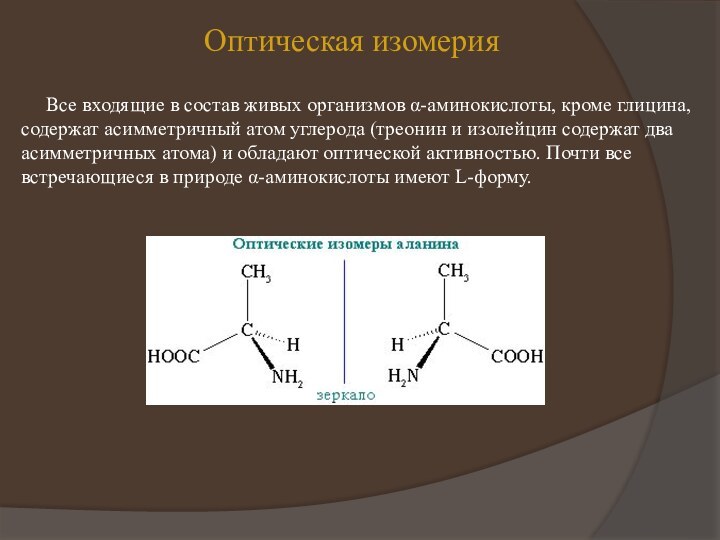
появляются первые работы по химическому изучению белков. Уже в
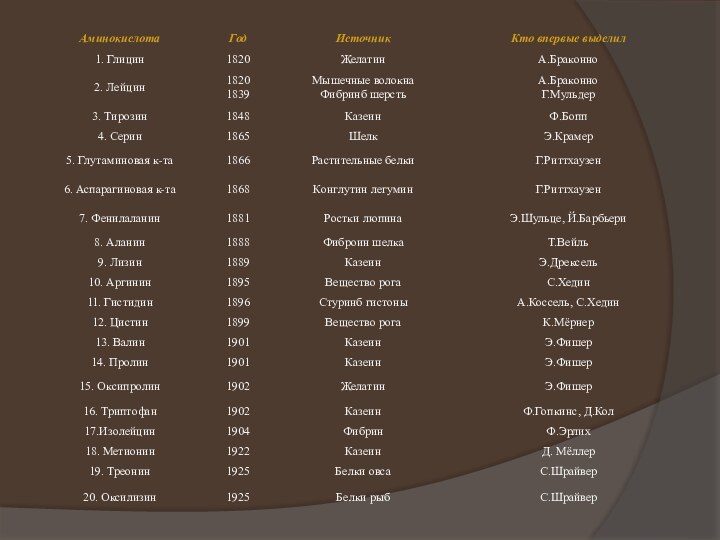
1803 г. Дж. Дальтон дает первые формулы белков - альбумина и желатина - как веществ, содержащих азот. В 1810 г. Ж. Гей-Люссак проводит химические анализы белков - фибрина крови, казеина и отмечает сходство их элементного состава. Решающее значение для понимания химической природы белков имело выделение при их гидролизе аминокислот. Вероятно, первым это сделал А. Браконно в 1820 г., когда, действуя на белки серной кислотой, при кипячении он получил «клеевой сахар», или гликокол (глицин), при гидролизе фибрина из мяса - лейцин и при разложении шерсти - также лейцин и смесь других продуктов гидролиза. Первой открытой аминокислотой был, видимо, аспарагин, выделенный Л. Вокленом из сока спаржи Asparagus (1806). В это же время Ж. Пруст получил лейцин при разложении сыра и творога. Затем из продуктов гидролиза белка были выделены многие другие аминокислоты(табл. 1).