- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Урок, презентация, планирование, карта урока на тему Окислительно-восстановительные реакции
Содержание
- 2. Что объединяет эти реакции?Cu +2SO4 + Fe0
- 3. Тема урока: Окислительно-восстановительные реакции
- 4. План урока1.Окисление, восстановление.2. Окислитель, восстановитель.3.Важнейшие окислители, восстановители.4.
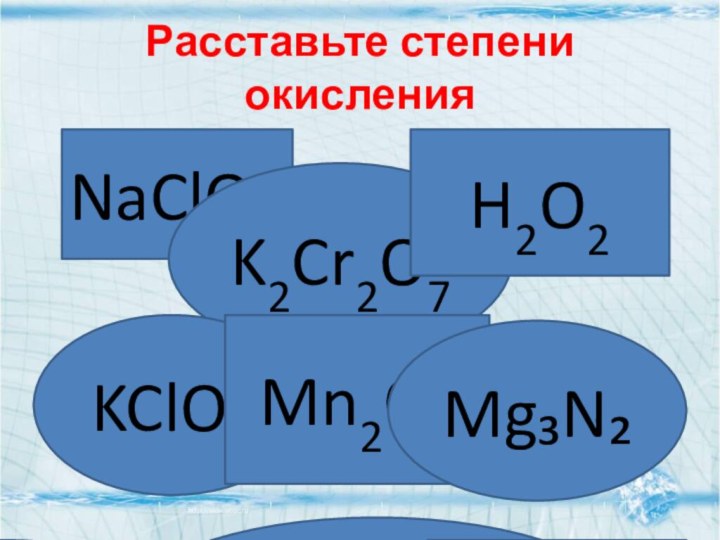
- 5. Расставьте степени окисленияNaClONa⁺¹CL⁺¹O⁻²K2Cr2O7 H2O2KClO3 K⁺¹Cl⁺⁵O⁻²3 Mn2O7Mg₃N₂Mg⁺²₃N₂⁻³K⁺¹2Cr⁺⁶2O⁻²7 Mn⁺⁷2O⁻²7H⁺¹2O⁻¹2
- 6. Окислитель , восстановительВосстановление – это процесс_____________электронов.Окисление – это процесс_______________электронов.Окислитель – это частица____________электроны.Восстановитель – это частица____________электроны.
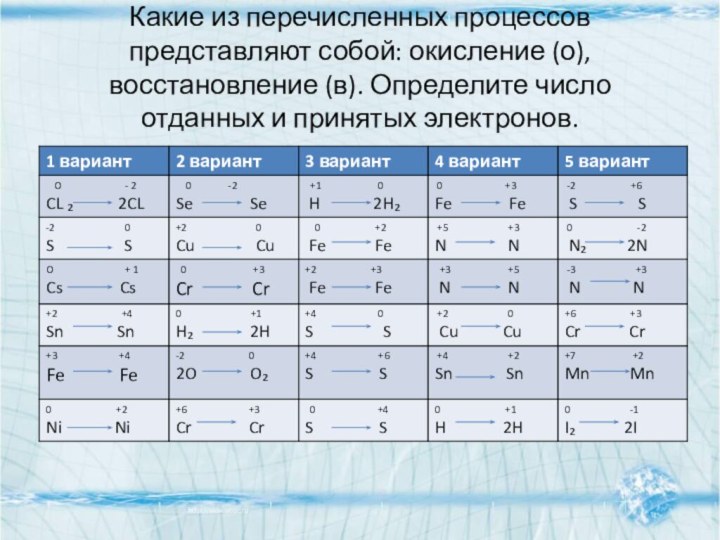
- 7. Какие из перечисленных процессов представляют собой: окисление (о), восстановление (в). Определите число отданных и принятых электронов.
- 8. Ответы:
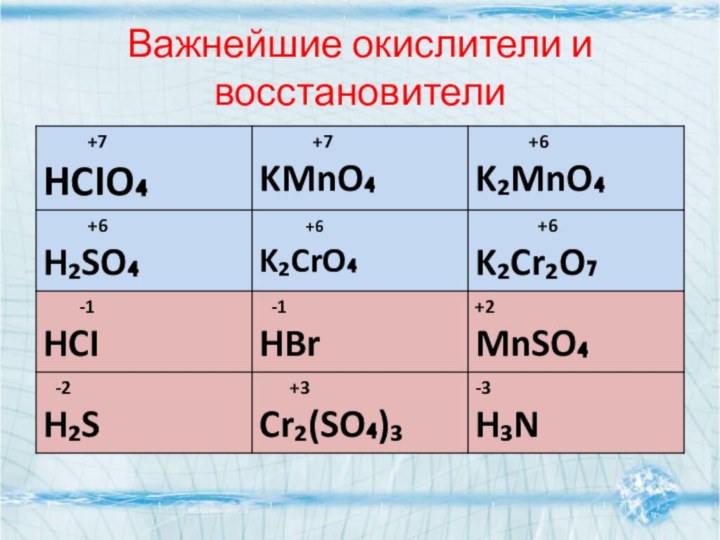
- 9. Важнейшие окислители и восстановители
- 10. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИОкислительно-восстановительными называют реакции, которые сопровождаются _____________степеней окисления химических элементов, входящих в состав реагентов.изменением
- 11. Классификация ОВР1.Межмолекулярные реакции: Частицы- доноры электронов
- 12. 2. Внутримолекулярные реакции Донор электронов - восстановитель-
- 13. 3. Реакции дисмутации, или диспропорционирования, или самоокисления-самовосстановления.
- 14. Алгоритм составления ОВР методом электронного баланса. 1.
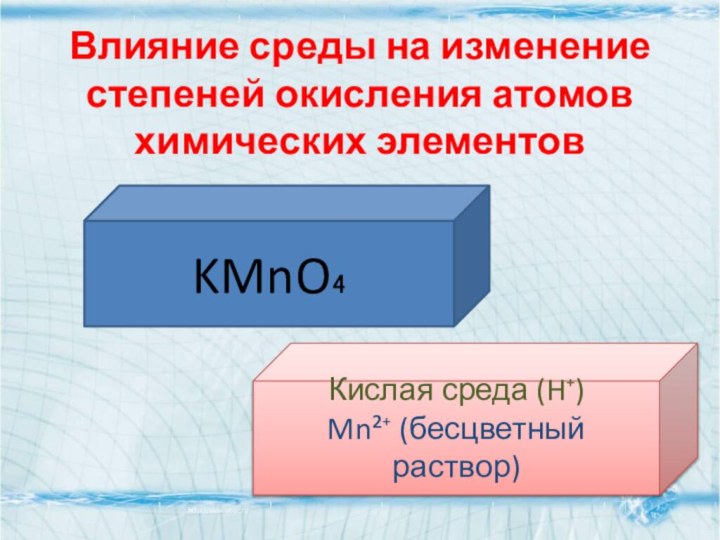
- 15. Влияние среды на изменение степеней окисления атомов химических элементовKMnO₄Кислая среда (H⁺)Mn²⁺ (бесцветный раствор)
- 16. Восстановление перманганата калия в кислой среде.KMn +7O4
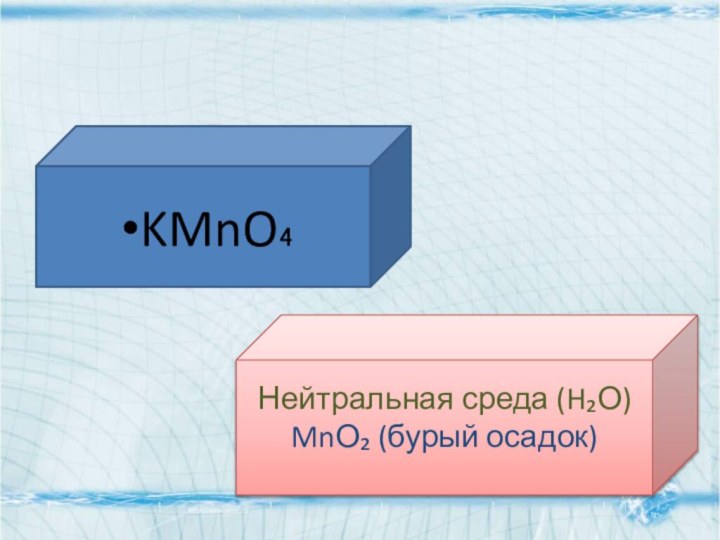
- 17. KMnO₄Нейтральная среда (H₂О)MnО₂ (бурый осадок)
- 18. Восстановление перманганата калия в нейтральной средеKMn +7O4
- 19. KMnO₄Щелочная среда (HО⁻)MnО₄²⁻ (р-р зеленого цвета)
- 20. Восстановление перманганата калия в щелочной среде.KMn +7O4
- 21. Влияние среды на изменение степеней окисления атомов химических элементов
- 22. Влияние среды на изменение степеней окисления атомов химических элементов
- 23. Влияние среды на изменение степеней окисления атомов химических элементов
- 24. Решите самостоятельно:NaMnO4 +KNO2 +H 2SO4→________________+KNO3+Na 2SO4+H 2OMn+7+5e-
- 25. ПРОЦЕСС ОКИСЛЕНИЯ Окислением называют процесс отдачи электронов
- 26. Процесс ВОССТАНОВЛЕНИЯВосстановлением называют процесс присоединения электронов атомом, молекулой или ионом, который сопровождается понижением степени окисления.
- 27. Окислитель Окислителем называют реагент, который принимает электроны в ходе окислительно-восстановительной реакции.
- 28. Скачать презентацию
- 29. Похожие презентации
Что объединяет эти реакции?Cu +2SO4 + Fe0 →Fe +2SO4+ Cu02Ca0 + O20→ 2Ca +2O-22CL20 +Ca(OH)2→Ca(CL +1O)2 +CaCL2-1 +2H2O























Слайд 4
План урока
1.Окисление, восстановление.
2. Окислитель, восстановитель.
3.Важнейшие окислители, восстановители.
4. Классификация
ОВР.
5. Влияние среды на изменение степеней окисления атомов химических
элементов.
Слайд 5
Расставьте степени окисления
NaClO
Na⁺¹CL⁺¹O⁻²
K2Cr2O7
H2O2
KClO3
K⁺¹Cl⁺⁵O⁻²3
Mn2O7
Mg₃N₂
Mg⁺²₃N₂⁻³
K⁺¹2Cr⁺⁶2O⁻²7
Mn⁺⁷2O⁻²7
H⁺¹2O⁻¹2
Слайд 6
Окислитель , восстановитель
Восстановление – это процесс_____________электронов.
Окисление – это
процесс_______________электронов.
Окислитель – это частица____________электроны.
Восстановитель – это частица____________электроны.
Слайд 7 Какие из перечисленных процессов представляют собой: окисление (о),
восстановление (в). Определите число отданных и принятых электронов.
Слайд 10
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно-восстановительными называют реакции, которые сопровождаются _____________степеней окисления
химических элементов, входящих в состав реагентов.
изменением
Слайд 11
Классификация ОВР
1.Межмолекулярные реакции: Частицы- доноры электронов (восстановители)
– и частицы- акцепторы электронов (окислители) – находятся _______________
К
этому типу относится большинство ОВР.в разных веществах
Слайд 12 2. Внутримолекулярные реакции Донор электронов - восстановитель- и акцептор
электронов – окислитель – находятся в __________________
одном и том
же веществе.Слайд 13 3. Реакции дисмутации, или диспропорционирования, или самоокисления-самовосстановления. Атомы
одного и того же элемента в веществе выполняют одновременно
функции и доноров электронов (восстановителей) и акцепторов электронов (окислителей). Эти реакции возможны для веществ, содержащих атомы химических элементов в промежуточной степени окисления
Слайд 14
Алгоритм составления ОВР методом электронного баланса.
1. Записать
формулы исходных веществ и продуктов реакции и указать степени
окисления элементов.2.Подчеркнуть знаки химических элементов, изменивших свои степени окисления в процессе реакции.
3. Составить схему электронного баланса, определить процессы окисления и восстановления. Найти НОК для числа отданных и принятых электронов и коэффициенты при окислителе и восстановителе.
4. Расставим коэффициенты перед формулами веществ в уравнении реакции.
5. Проверим правильность составления уравнения, сверяя число атомов каждого элемента в левой и правой частях уравнения.
Слайд 15 Влияние среды на изменение степеней окисления атомов химических
элементов
KMnO₄
Кислая среда (H⁺)
Mn²⁺ (бесцветный раствор)
Слайд 16
Восстановление перманганата калия в кислой среде.
KMn +7O4 +
KI-1+H 2S +6O4 →
______________+ I20+K 2S +6O4+H
2OMn+7+5e- → Mn+2│2│пр.восст │окислитель
2 I-1- 2e - →I2 │5│пр.окисл│восстановитель
2KMn +7O4 + 10 KI-1+ 8 H 2S +6O4 → 2Mn +2SO4 + 5 I20+6 K 2S +6O4+8 H 2O
Mn +2SO4
Слайд 18
Восстановление перманганата калия в нейтральной среде
KMn +7O4 +
K 2S +4O3+Н 2O →
_____________+K 2S +6O4+KOH
Mn+7+3e-
→ Mn+4│2│пр.восст │окислительS+4- 2e - → S+6 │3│пр.окисл│восстановитель
2 KMn +7O4 + 3 K 2S +4O3+Н 2O → 2 Mn +4O2 +3 K 2S +6O4+ 2KOH
Mn +4O2
Слайд 20
Восстановление перманганата калия в щелочной среде.
KMn +7O4 +
K 2S +4O3+KOH →
___________+K 2S +6O4+H 2O
Mn+7+1e-
→ Mn+6│2│пр.восст │окислительS+4- 2e - → S+6 │1│пр.окисл│восстановитель
2 KMn +7O4 + K 2S +4O3+ 2 KOH →
2 K 2Mn +6O4 +K 2S +6O4+H 2O
K 2Mn +6O4
Слайд 24
Решите самостоятельно:
NaMnO4 +KNO2 +H 2SO4→
________________+KNO3+Na 2SO4+H 2O
Mn+7+5e- →
Mn+2 │2│пр.восст │окислитель
N+3- 2e - →
N+5 │5│пр.окисл│восстановитель2NaMnO4 +5KNO2 +3H 2SO4 →2MnSO4+5KNO3+Na 2SO4+3H 2O
MnSO4





























