Слайд 2
Історія спирту
Етиловий спирт, точніше рослинний хмільний напій, що

його містить, був відомий людству з глибокої давнини. Вважається,
що не менш, ніж за 8000 років до нашої ери люди виготовляли легкі спиртні напої з фруктів і меду.
Вперше спирт з вина отримали в 6-7 століттях арабські хіміки, а першу пляшку міцного алкоголю (прообразу сучасної горілки) виготовив перський алхімік Ар-Рази в 860 році.Структурна формула етанолу
У Європі етиловий спирт був отриманий із продуктів бродіння в 11-12 столітті в Італії.
До Росії спирт вперше потрапив у 1386 році, коли генуезьке посольство привезло його з собою під назвою «аква віта» і презентувала царського двору.
У 1660 році англійський хімік і богослов Роберт Бойль вперше отримав зневоднений етиловий спирт, а також відкрив його деякі фізичні і хімічні властивості, зокрема виявивши здатність етанолу бути високотемпературним пальним для пальників. Абсолютний (безводний) етиловий спирт був отриманий у 1796 році російським хіміком Т.Є. Ловіцем.
У 1842 році німецький хімік Якоб Генріх Вільгельм Шіль (1813-1889) відкрив, що спирти утворюють гомологічний ряд, відрізняючись на деяку постійну величину. Щоправда, він помилився описавши її як C2H2. Через два роки, інший хімік Шарль Жерар встановив правильне гомологічної співвідношення CH2 і передбачив формулу і властивості невідомого в ті роки пропілового спирту.
У 1850 році англійський хімік Олександр Вільямсон, досліджуючи реакцію алкоголятів з етилйодидом, встановив, що етиловий спирт є похідним від води з одним зміщенням Гідрогеном, експериментально підтвердив формулу C2H5OH.
Слайд 3
Історія спирту
Вперше синтез етанолу дією сірчаної кислоти на

етилен здійснив у 1854 році французький хімік Марселен Бертло.
Перше
дослідження метилового спирту було проведено в 1834 році французькими хіміками Жаном-Батистом Дюма і Еженом Пеліго; вони назвали його «метиловим або деревним спиртом», так як він був виявлений в продуктах сухої перегонки деревини. Синтез метанолу з метилхлориду здійснив французький хімік Марселен Бертло в 1857 році. Ним же вперше був відкритий в 1855 році ізопропіловий спирт, синтезований дією на пропен водної сірчаної кислоти.
Вперше третинний спирт (трет-бутанол, 2-метил-пропан-2-ол) синтезував в 1863 році відомий російський вчений А. М. Бутлеров, поклавши початок цілої серії експериментів у цьому напрямку.
Молекула етиленгліколю, найпростішого діолу
Представник двоатомних спиртів — етиленгліколь — вперше був синтезований французьким хіміком А. Вюрцом в 1856 році. Триатомний спирт — гліцерин — був виявлений у природних жирах ще в 1783 році шведським хіміком Карлом Шеєле, однак його склад був відкритий тільки в 1836 році, а синтез здійснено з ацетону в 1873 році Шарлем Фріделем.
Слайд 4
Класифікація спиртів
Якщо до складу молекули спирту входить одна

гідроксильна група, то такий спирт називають одноатомним, коли дві
— двоатомним і т. д. Спирти, молекули яких містять дві і більше гідроксильних груп, називають багатоатомними. Якщо спирт походить від насиченого вуглеводню, то його називають насиченим, а коли від ненасиченого, то ненасиченим. В залежності від типу атома, до якого приєднана гідроксильна група спирти поділяють на первинні, вторинні та третинні.
Спирти, як і вуглеводні, утворюють гомологічні ряди. Кожний наступний член цього ряду відрізняється від попереднього на гомологічну різницю -CH2-.
Назви спиртів походять від назв вуглеводневих радикалів, що входять до складу молекули спиртів. Міжнародні їх назви утворюються з назв відповідних вуглеводів з додаванням закінчення ол. Наприклад, CH3—OH — метиловий спирт, або метанол; C2H5—OH — етиловий спирт, або етанол і т. д.
Загальна формула одноатомних насичених спиртів CnH2n+1OH або R—OH, де R — вуглеводневий радикал. В таблиці наведений гомологічний ряд насичених одноатомних спиртів.
Нижчі спирти (з малою кількістю атомів Карбону в молекулі) при звичайній температурі є леткими рідинами, а вищі, починаючи з C15H31—OH, — тверді речовини. Нижчі спирти з водою зміщуються у всіх співвідношеннях. З підвищенням молекулярної маси розчинність спиртів зменшується. Усі спирти легші від води. В міру збільшення молекулярної маси температура кипіння спиртів підвищується.
Слайд 5
Хімічні властивості спиртів
Кислотно-основні властивості
Дегідратація
Естерифікація
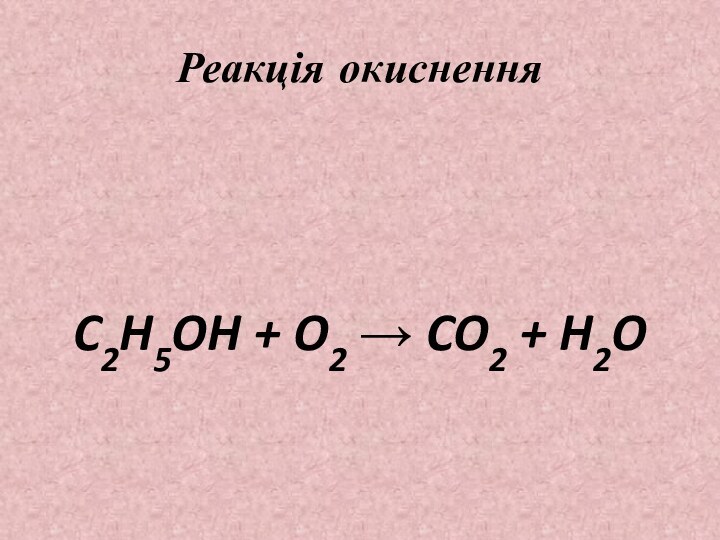
Реакція окиснення
Слайд 6
Кислотно-основні властивості
Характерною хімічною властивістю спиртів є їх здатність
Характерною хімічною властивістю спиртів є їх здатність взаємодіяти з
лужними металами і заміщувати гідроксильні атоми водню атомами металу з утворенням речовин, які називають алкоголятами. Наприклад:
2C2H5—OH + 2Na → 2C2H5—ONa + H2 ↑.
Інші атоми Гідрогену, котрі зв'язані безпосередньо з Карбоном, у реакцію не вступають. На прикладі цих реакцій науковці вперше зустрілись з явищем впливу одних атомів на інші в молекулі. Суть цього впливу можна показати на прикладі молекули етилового спирту, електронну будову якої можна зобразити в такому вигляді:будову якої можна зобразити в такому вигляді:
Слайд 7
Кислотно-основні властивості
Гідроксильний атом Гідрогену займає в молекулі особливе
положення. На відміну від інших атомів Гідрогену, він не
безпосередньо зв'язаний з атомом Карбону, а через Оксиген. Атом Оксигену, як активніший елемент більше, ніж Карбон, відтягує до себе спільну електронну пару. Внаслідок цього гідроксильний атом Гідрогену слабкіше зв'язаний в молекулі, ніж інші атоми Гідрогену, і є більш «рухливим», тому порівняно легко витісняється атомом металу. Реакції спиртів з металами в дечому нагадують реакції кислот з металами. В молекулах спиртів гідроксильні атоми Гідрогену значно тісніше зв'язані з Оксигеном, ніж у молекулах кислот. Тому спирти на відміну від кислот не дисоціюють у воді і іонів Гідрогену не утворюють.
У спиртах можуть заміщатися не лише гідроксильні атоми Гідрогену, а і вся гідроксильна група. Наприклад, при нагріванні етилового спирту з бромоводнем утворюється бромоетан:
Слайд 8
Дегідратація
Для спиртів характерним є також реакції дегідратації (відщеплення
води). Так, при нагріванні вище 160°С етилового спирту з
надлишком концентрованої сульфатної кислоти як водовіднімаючого засобу від одної молекули спирту відщеплюється одна молекула води і етиловий спирт перетворюється в етилен: При При слабшому нагріванні (близько 140°С) суміші етилового спирту з сульфатною кислотою при надлишку спирту молекула води відщеплюється не від однієї, а від двох молекул спирту, внаслідок чого утворюється не етилен, а діетиловий ефір:
Слайд 9
Естерифікація
Крім того, для спиртів характерні також реакції взаємодії
з кислотами, внаслідок чого утворюються складні ефіри. При цьому
за рахунок гідроксильної групи кислоти і гідроксильного атома Гідрогену спирту утворюється молекула води, а за рахунок залишків молекул кислоти і спирту — молекули складного ефіру. Наприклад, при легкому нагріванні (не вище 100 °C) етилового спирту з сульфатною кислотою утворюється сульфатноетиловий ефір або діетилсульфат: