- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Урок по теме Соли
Содержание
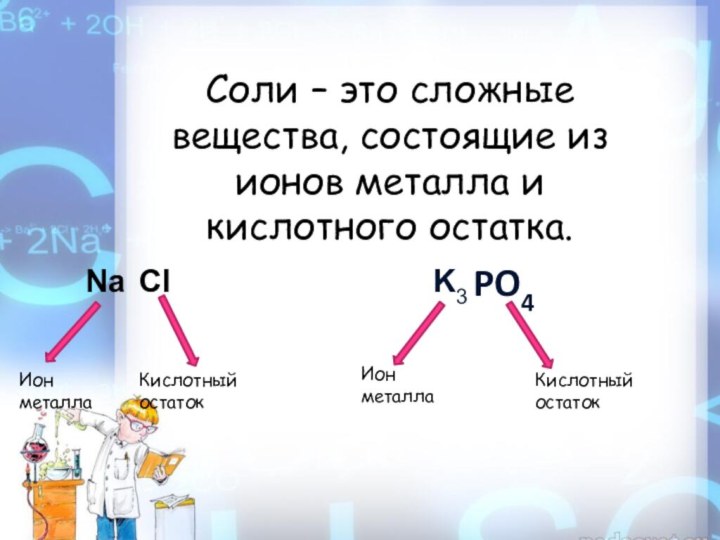
- 2. Соли – это сложные вещества, состоящие из ионов металла и кислотного остатка.PO4Ион металлаКислотный остатокИон металлаКислотный остатокNaClK3
- 4. Состав и название солейH2S - сульфиды
- 5. Номенклатура солей
- 6. классификация
- 9. Химические свойства1. Взаимодействие с металлами:
- 10. Химические свойства 2. Взаимодействие со щелочами:
- 11. Химические свойства3. Взаимодействие солеймежду собойКСl + AgNO3 → AgCl + KNO3
- 12. Химические свойства4.Взаимодействие с кислотами:Сильные кислоты вытесняют более
- 13. Химические свойства Разложение при нагревании
- 14. Основными солями называют соли,
- 15. Получение солей Металлы + кислота = соль + водород
- 16. соль+ металл = н.соль+ н.металл CuSO4+Fe =FeSO4+ CuПолучение cоли
- 17. Получение соли основный оксид +
- 18. Способы получения 1. Кислота + основание
- 19. Скачать презентацию
- 20. Похожие презентации
Соли – это сложные вещества, состоящие из ионов металла и кислотного остатка.PO4Ион металлаКислотный остатокИон металлаКислотный остатокNaClK3













Слайд 4
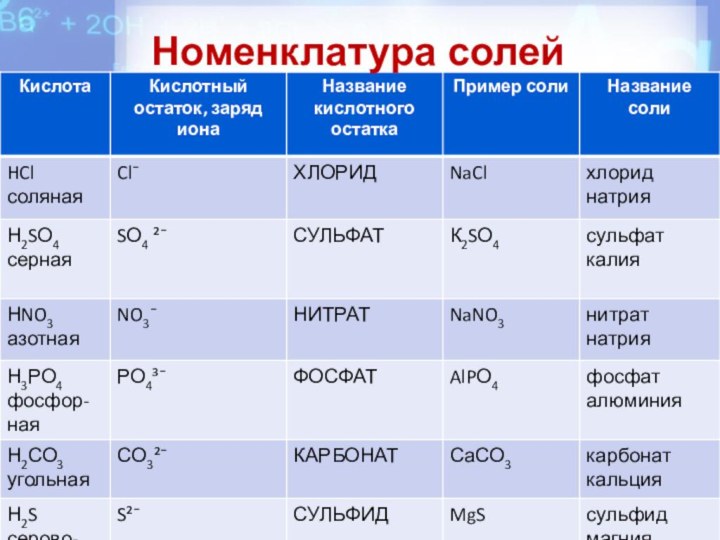
Состав и название солей
H2S - сульфиды
MgS сульфид магния
III IHNO3- нитраты Fe(NO3)3-нитрат железа (III)
H2SO4- сульфаты K2SO4 сульфат калия
H2CO3 - карбонаты СaCO3 карбонат кальция
H3PO4 - ортофосфаты K3PO4 ортофосфат калия Соли HCl - хлориды NaCl хлорид натрия
Слайд 7
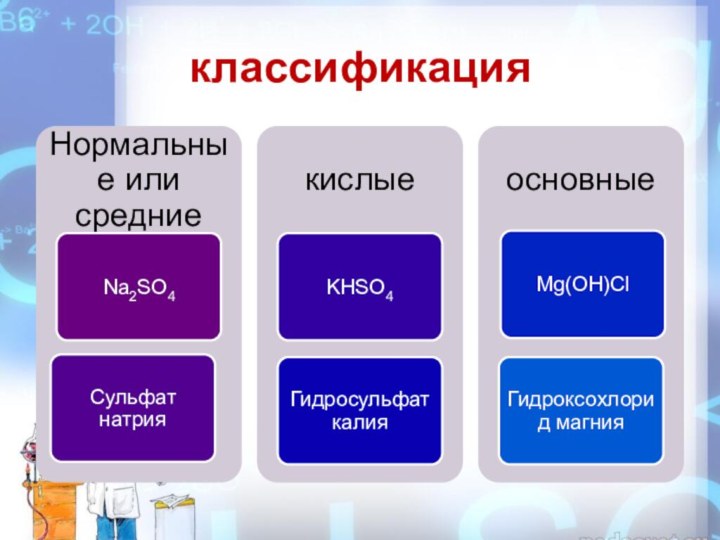
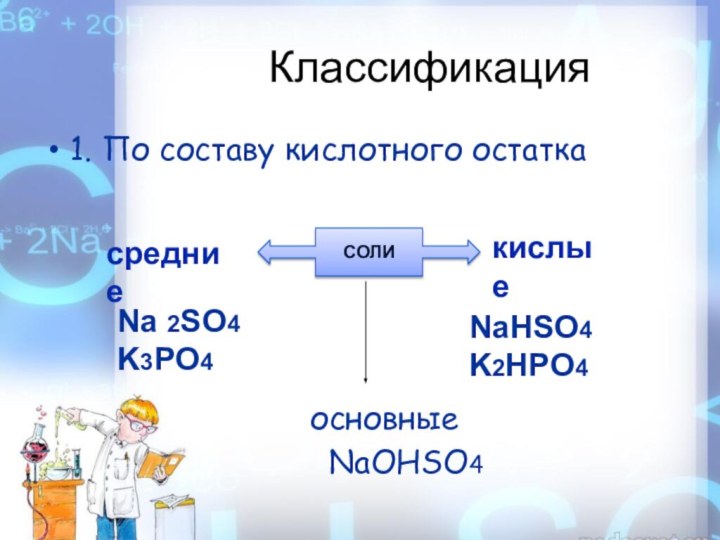
Классификация
1.
По составу кислотного остатка
основные
NaOHSO4
СОЛИ
средние
кислые
Na 2SO4
K3PO4
NaHSO4
K2HPO4
Слайд 8
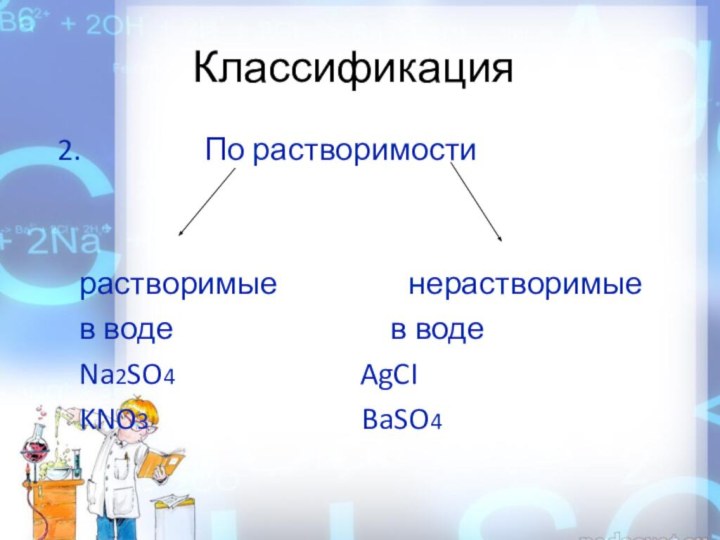
Классификация
2.
По растворимостирастворимые нерастворимые
в воде в воде
Na2SO4 AgCI
KNO3 BaSO4
Слайд 12
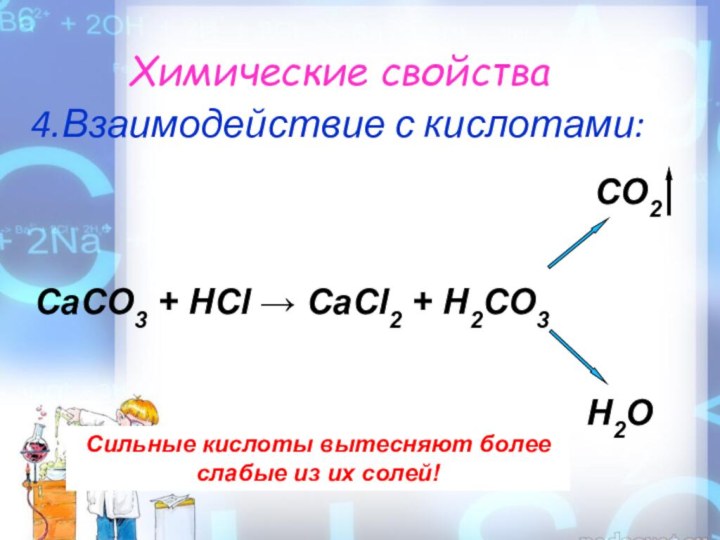
Химические свойства
4.Взаимодействие с кислотами:
Сильные кислоты вытесняют более слабые
из их солей!
CO2CaCO3 + HCl → CaCl2 + H2CO3
H2O
Слайд 14 Основными солями называют соли, молекулах
которых, кроме кислотных остатков, имеются также гидроксогруппы
(получаются при избытке оснований):Mg(OH)2 + HCI =M g(OH)CI + H2O
основный хлорид магния
гидроксохлорид магния
Слайд 18
Способы получения
1. Кислота + основание = соль
+ вода
H2SO4 +2NaOH = Na2SO4
+ 2H2O2. Кислота + металл = соль + водород
2HCL +Zn = ZnCL2 + H2
3. Кислота + основный оксид = соль + вода
2HCL + CuO = CuCL2 + H2O
4. Кислота + соль = новая кислота + новая соль
H2SO4 + BaCL2 = 2HCL + BaSO4
Условия: в результате реакции должны получиться газ, осадок или вода.
Основаны на химических свойствах оксидов,
оснований, кислот





























