- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Обратимость химических реакций. Обратимые и необратимые химические реакции. Химическое равновесие
Содержание
Обратимые и необратимые химические реакцииХимические реакции, протекающие в одном направлении, называются необратимыми. Химические реакции, протекающие при одних и тех же условиях одновременно в двух противоположных направлениях, называются обратимыми.





Слайд 2
Обратимые и необратимые химические реакции
Химические реакции, протекающие в
одном направлении, называются необратимыми.
и тех же условиях одновременно в двух противоположных направлениях, называются обратимыми.
Слайд 3
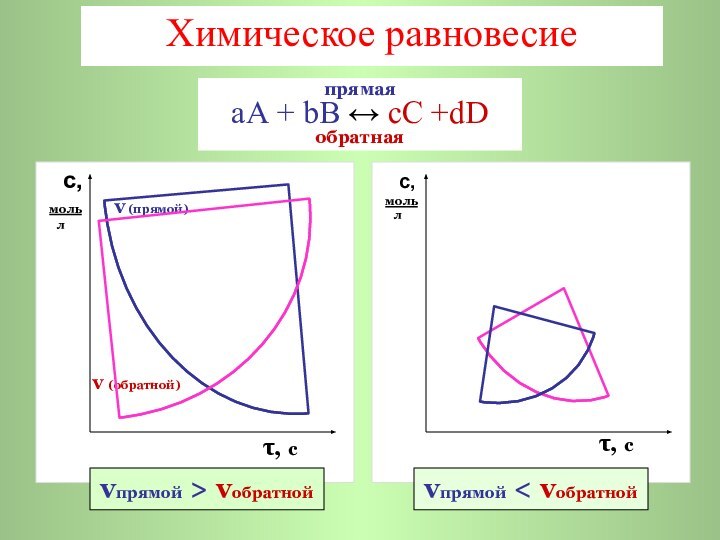
Химическое равновесие
с,
моль
v (прямой)
л
v (обратной)τ, с
с,
моль
л
τ, с
прямая
аА + bB ↔ cC +dD
обратная
vпрямой > vобратной
vпрямой < vобратной
Слайд 4
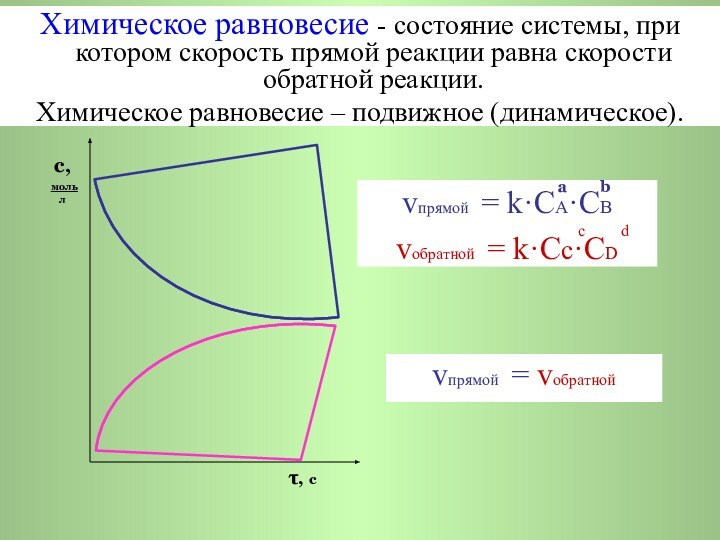
a b vпрямой = k·CA·СB с d vобратной = k·Cс·СD
с,
моль
л
τ, с
vпрямой = vобратной
Химическое равновесие - состояние системы, при котором скорость прямой реакции равна скорости обратной реакции.
Химическое равновесие – подвижное (динамическое).
Слайд 5
Принцип Ле-Шателье:
«Если на систему,
находящуюся в равновесии, производится внешнее воздействие (изменяются концентрация, температура,
давление), то равновесие смещается в сторону той реакции, которая ослабляет это воздействие».
Слайд 6
1. Концентрация:
а) при увеличении
концентрации исходных веществ равновесие смещается в сторону прямой реакции
(вправо);б) при увеличении концентрации продуктов реакции равновесие смещается в сторону обратной реакции (влево).
2. Температура:
При увеличении температуры равновесие всегда смещается в сторону эндотермической реакции.
3. Давление:
При увеличении давления равновесие смещается в сторону той
реакции, которая приводит к уменьшению объёмов газообразных веществ.