- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Железо
Содержание
- 2. ОГЛАВЛЕНИЕ1) ЖЕЛЕЗО КАК ЭЛЕМЕНТ3) НАХОЖДЕНИЕ В ПРИРОДЕ6)
- 3. Положение элемента- железа в периодической системе Д.И.
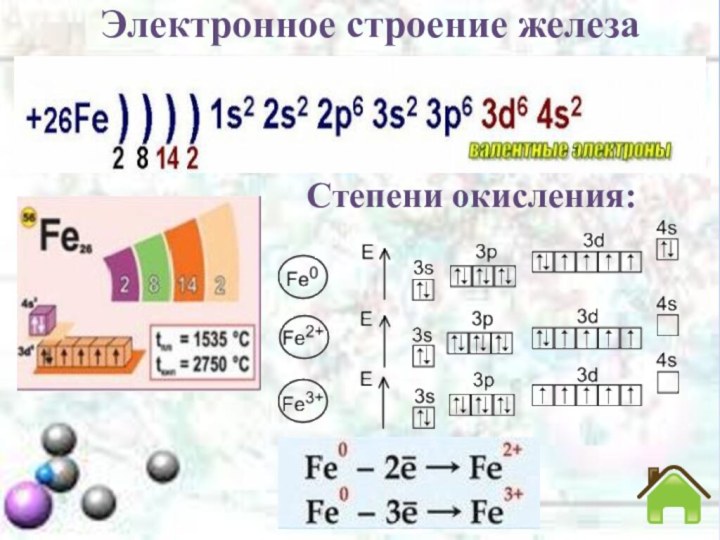
- 4. Электронное строение железаСтепени окисления:
- 5. Физические свойства железаЖелезо- сравнительно мягкий, ковкий серебристо-серый
- 6. Нахождение в природе В земной коре железо
- 7. 1) Восстановление оксидов железа металлотермией:Получение железа3FeO +
- 8. Химические свойства1. Реакции с простыми веществамиЖелезо сгорает
- 9. Химические свойства2. Реакции со сложными веществами С
- 10. магнитный железняк (магнетит -
- 11. Железо играет важную роль в жизнедеятельностиживых организмов.
- 12. Скачать презентацию
- 13. Похожие презентации







Слайд 3
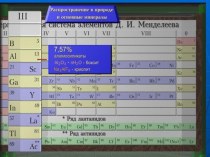
Положение элемента- железа в периодической системе
Д.И. Менделеева.
Это элемент № 26
Это элемент
IV периода
Это элемент 8
группы побочной подгруппы
Металл
Электронное строение железа
Слайд 5
Физические свойства железа
Железо- сравнительно мягкий, ковкий серебристо-серый металл
Температура
плавления 15350C
Температура кипения 28000C
При температуре ниже 7700C железо
обладает ферромагнитными свойствами (оно легко намагничивается)
Слайд 6
Нахождение в природе
В земной коре железо распространено
достаточно широко: на его долю приходится около 4,1% массы
земной коры (4-е место среди всех элементов, 2-е среди металлов). Известно большое число руд и минералов, содержащих железо.Встречается железо в виде различных соединений: оксидов, сульфидов, силикатов. В свободном виде железо находят в метеоритах, изредка встречается самородное железо (феррит) в земной коре как продукт застывания магмы.
Слайд 7
1) Восстановление оксидов железа металлотермией:
Получение железа
3FeO + 2Al
Al2O3 + 3Fe
2) Доменный процесс:
С + O2
CO2 + C 2CO↑кокс
3Fe2O3 + CO 2Fe3O4 + CO2↑
Оксид Fe(III) называют оксид железа(II, III)
Fe3O4 + CO 3FeO + CO2↑
FeO + CO Fe + CO2↑
Слайд 8
Химические свойства
1. Реакции с простыми веществами
Железо сгорает в
чистом кислороде при нагревании:4Fe +3O2=2Fe2O3
Реагирует с галогенами при нагревании:2Fe
+ 3CL2=2FeCL3Реагирует с порошком серы при нагревании:Fe +S = FeS
Слайд 9
Химические свойства
2. Реакции со сложными веществами
С кислотами:
А)
с соляной кислотой
2HCL + Fe = FeCL2 + H2
Б)
с серной кислотойH2SO4 + Fe = FeSO4 + H2
С солями:
Fe + CuSO4= Cu + FeSO4
Слайд 10
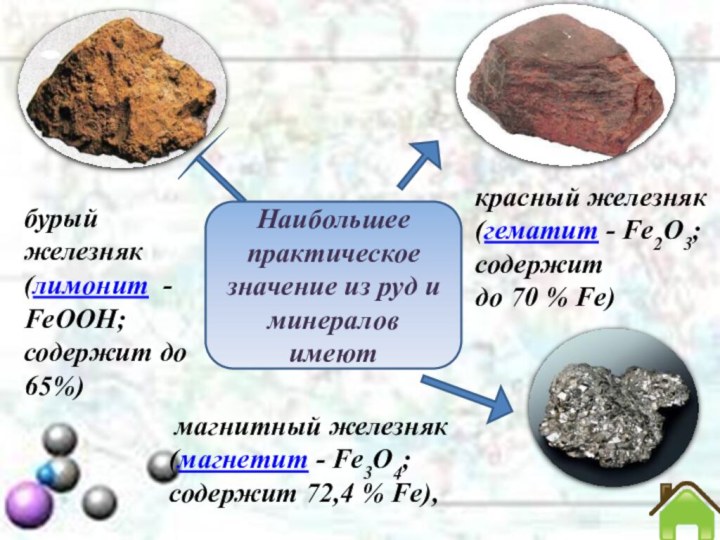
магнитный железняк (магнетит -
Fe3O4;
содержит 72,4 % Fe),
бурый железняк (лимонит -
FeOOH;
содержит
до 65%)красный железняк (гематит - Fe2O3; содержит
до 70 % Fe)
Наибольшее практическое значение из руд и минералов
имеют
Слайд 11
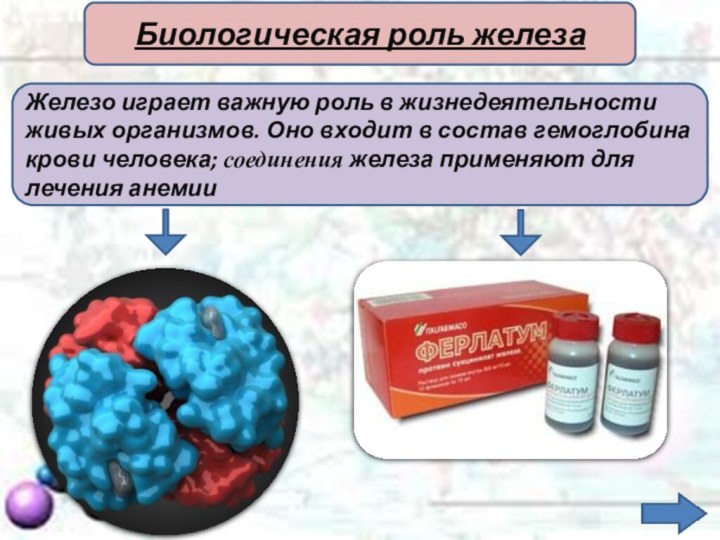
Железо играет важную роль в жизнедеятельности
живых организмов. Оно
входит в состав гемоглобина
крови человека; соединения железа применяют
для лечения анемииБиологическая роль железа