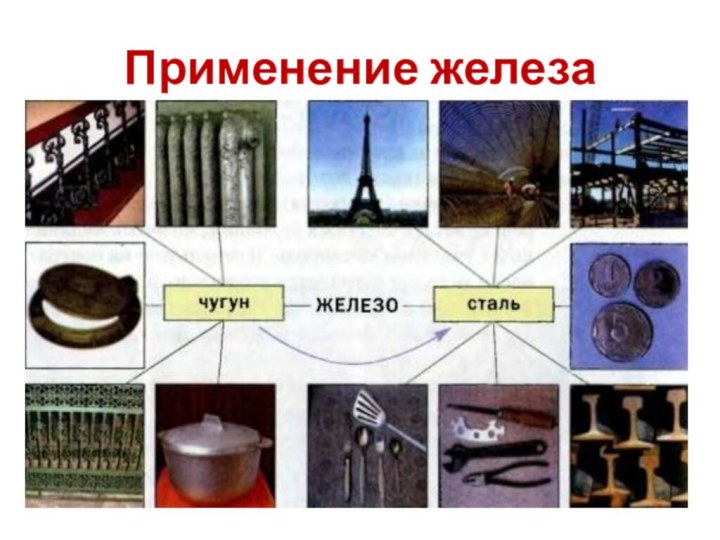
20 дм³ (н.у.) водородом, если для получения водорода взять
алюминий массой 100г и избыток раствора гидроксида натрия?n(Al) = 100 : 27 = 3,7 моль
3,7 моль Хмоль
2Al + 6 H2O + 2 NaOH = 2K[Al(OH)4] + 3H2
2 моль 3 моль
n(H2) = 3,7 ∙ 3 : 2 = 5,55 моль
V(H2) = 5,55 ∙ 22,4 = 124,32 л