Слайд 2
Цели и задачи урока
Цель урока – познакомить обучающихся
с классификацией неорганических веществ.
Задачи урока:
Образовательные: расширить углубить знания обучающихся
о классификации строении, свойствах основных классов неорганических соединений.
Развивающие: развивать логическое мышление путем сравнения, обобщения, систематизации, учить выделять причинно-следственные связи
(выявление зависимости свойств от строения)
Воспитывающие: развивать интерес к предмету, развивать взаимосвязь между предметами, развивать знания о применении химии в быту.
Слайд 3
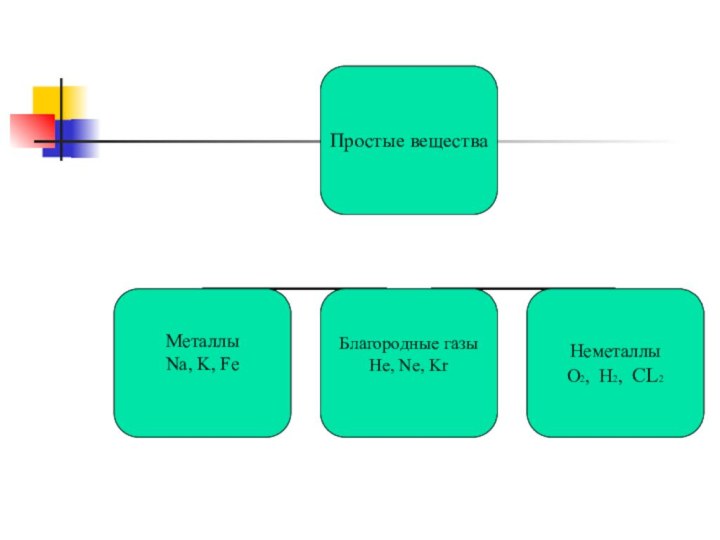
Общая классификация веществ по составу
Неорганические вещества
Простые вещества
Сложные
вещества
Слайд 4
Простые вещества состоят из атомов одного химического элемента
Сложные вещества состоят из атомов разных элементов, химически
связанных друг с другом
Слайд 7
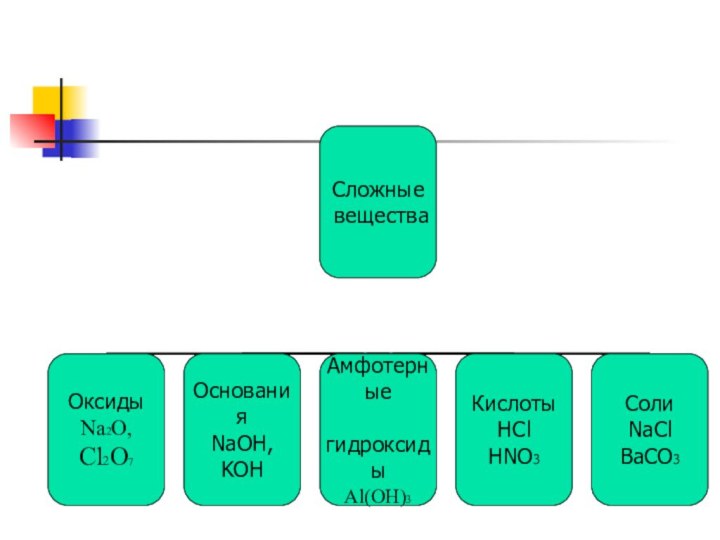
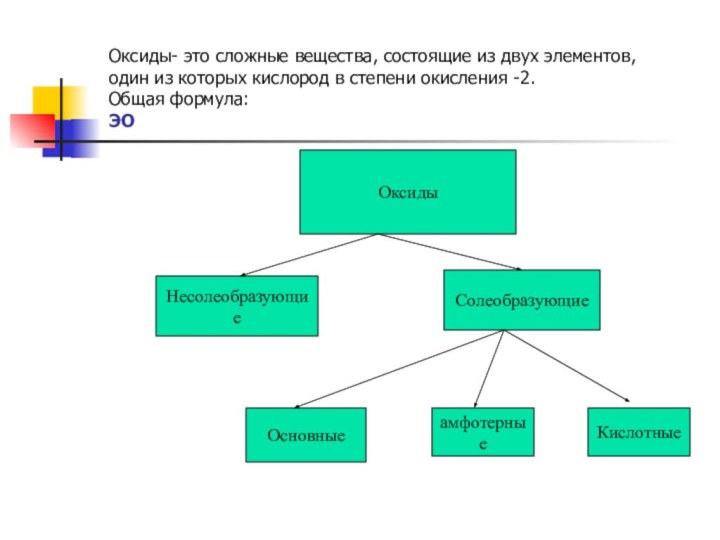
Оксиды
Несолеобразующие
Солеобразующие
Основные
амфотерные
Кислотные
Оксиды- это сложные вещества, состоящие
из двух элементов,
один из которых кислород в степени
окисления -2.
Общая формула:
ЭO
Слайд 8
-
Приведите примеры оксидов.
H2SO4
FeO
Fe(OH)2
SO3
FeSO4
Fe2O3
Fe2(SO4)3
H2SO3
Fe(OH)3
SO2
Слайд 9
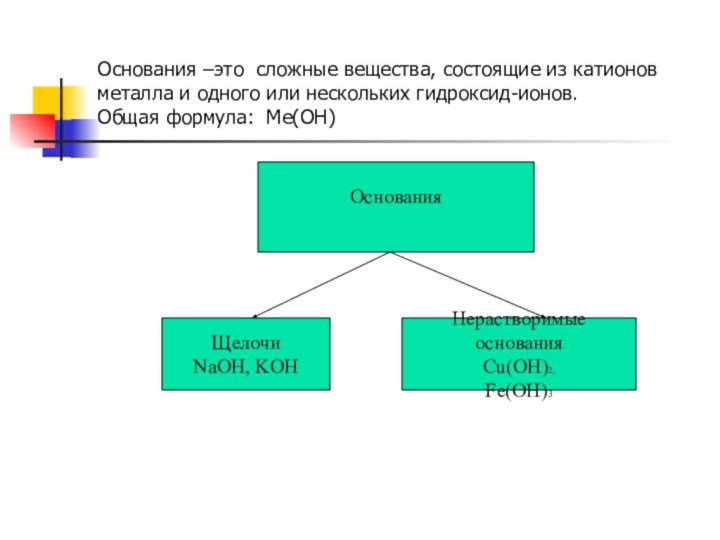
Основания –это сложные вещества, состоящие из катионов металла
и одного или нескольких гидроксид-ионов.
Общая формула: Me(OH)
Основания
Щелочи
NaOH,
KOH
Нерастворимые основания
Cu(OH)2,
Fe(OH)3
Слайд 10
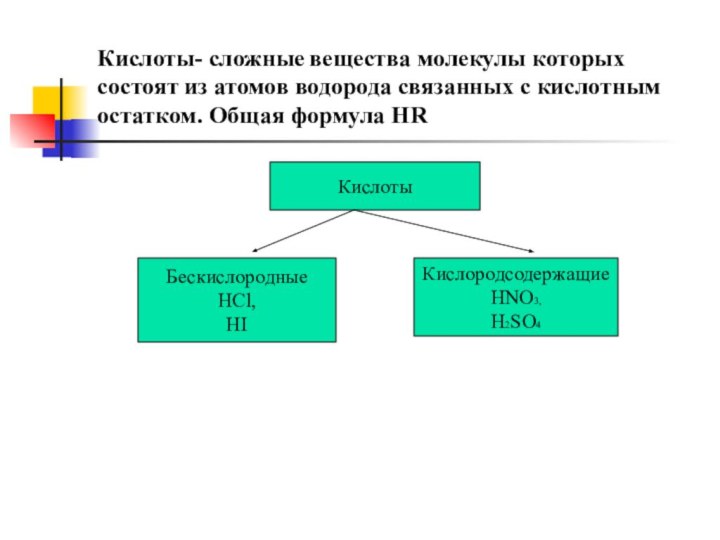
Кислоты- сложные вещества молекулы которых состоят из атомов
водорода связанных с кислотным остатком. Общая формула НR
Кислоты
Бескислородные
НСl,
HI
Кислородсодержащие
HNO3,
H2SO4
Слайд 11
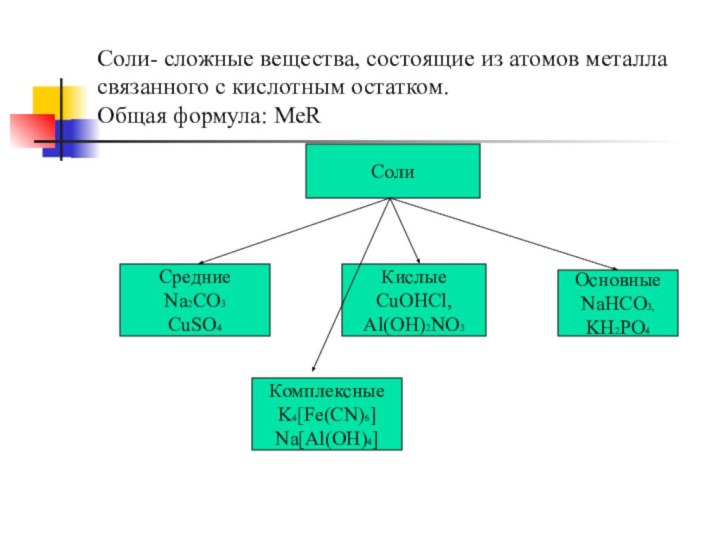
Соли- сложные вещества, состоящие из атомов металла связанного
с кислотным остатком.
Общая формула: МеR
Соли
Средние
Na2CO3
CuSO4
Кислые
CuOHCl,
Al(OH)2NO3
Основные
NaHCO3,
KH2PO4
Комплексные
K4[Fe(CN)6]
Na[Al(OH)4]
Слайд 12
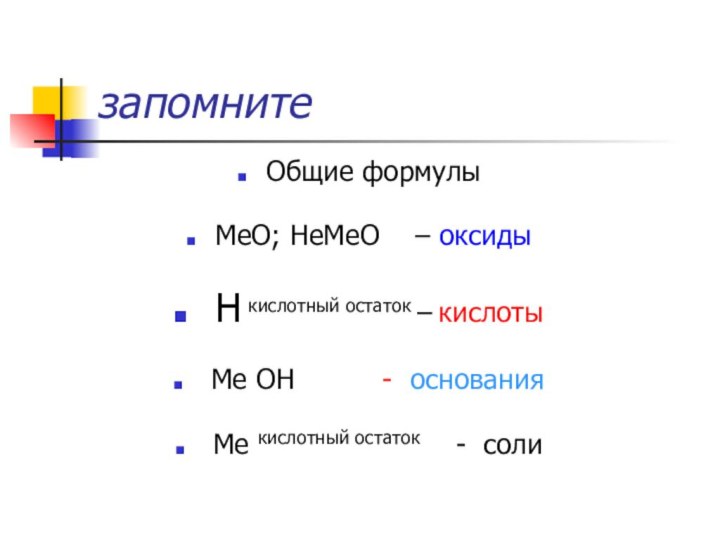
запомните
Общие формулы
МеО; НеМеО – оксиды
Н
кислотный остаток – кислоты
Ме ОН
- основания
Ме кислотный остаток - соли
Слайд 13
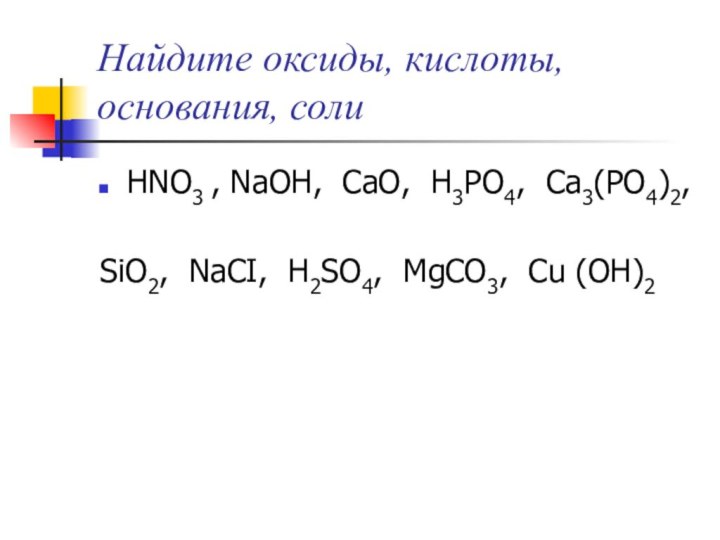
Найдите оксиды, кислоты, основания, соли
HNO3 , NaOH, CaO,
H3PO4, Ca3(PO4)2,
SiO2, NaCI, H2SО4, MgCO3, Cu (OH)2
Слайд 14
Проверьте себя
Оксиды: CaO –оксид кальция, SiO2 оксид кремния
;
Кислоты: HNO3 азотная кислота , H3PO4 фосфорная кислота, H2SО4
–серная кислота;
Основания: NaOH гидроксид натрия , Cu (OH)2-гидроксид меди ;
Соли: Ca3(PO4)2-фосфат кальция, MgCO3-карбонат магния , NaCI – хлорид натрия.
Слайд 15
NO
HNO
NaOH
HNO
2
3
К какому классу соединений относятся вещества,
дать им
названия
Слайд 16
1.Найдите в каждом ряду «лишнее» вещество и объясните
свой выбор:
Слайд 17
Проверь себя
NO – несолеобразующий оксид
Zn(OH)2 – амфотерное основание
H22SO4
– кислота
NaOH – основание
Слайд 18
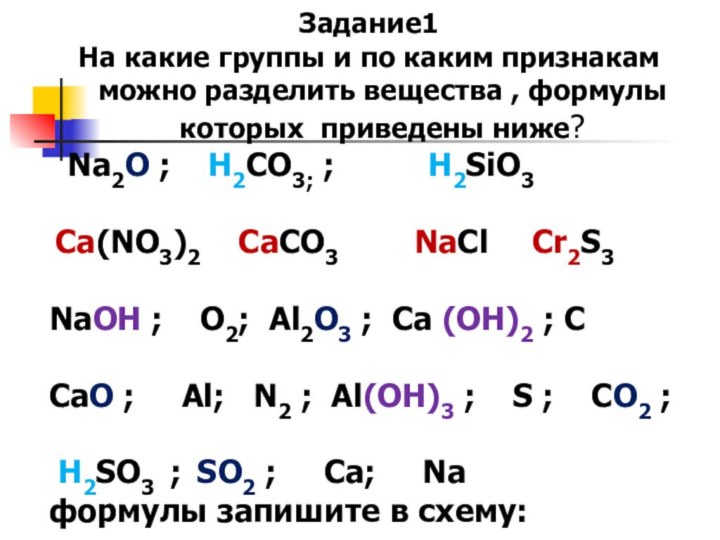
Задание1
На какие группы и по каким признакам можно
разделить вещества , формулы которых приведены ниже?
Na2O ;
H2CO3; ; H2SiO3
Ca(NO3)2 CaCO3 NaCl Cr2S3
NaOH ; О2; Al2O3 ; Ca (OH)2 ; С
СаO ; Аl; N2 ; Al(OH)3 ; S ; СО2 ;
H2SO3 ; SO2 ; Ca; Na
формулы запишите в схему:
Слайд 19
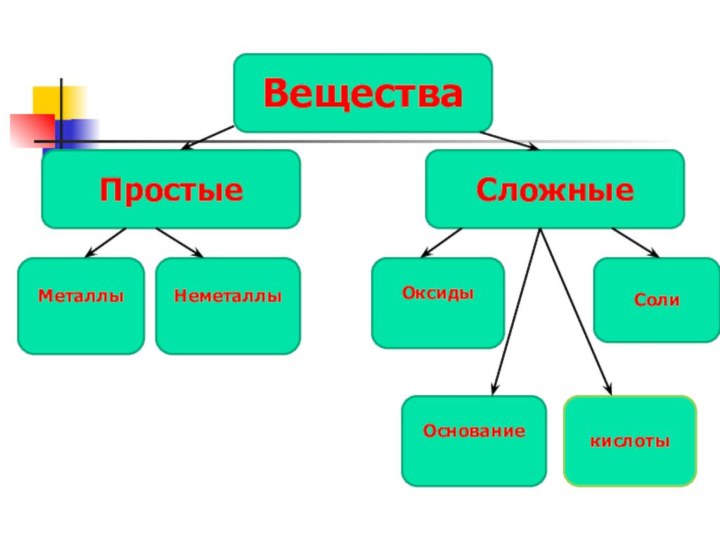
Вещества
Простые
Сложные
Металлы
Неметаллы
Оксиды
Основание
Соли
кислоты
Слайд 20
Задание1
На какие группы и по каким признакам можно
разделить вещества , формулы которых приведены ниже?
Na2O ;
H2CO3; ; H2SiO3
Ca(NO3)2 CaCO3 NaCl Cr2S3
NaOH ; О2; Al2O3 ; Ca (OH)2 ; С
СаO ; Аl; N2 ; Al(OH)3 ; S ; СО2 ;
H2SO3 ; SO2 ; Ca; Na
формулы запишите в схему:
Слайд 21
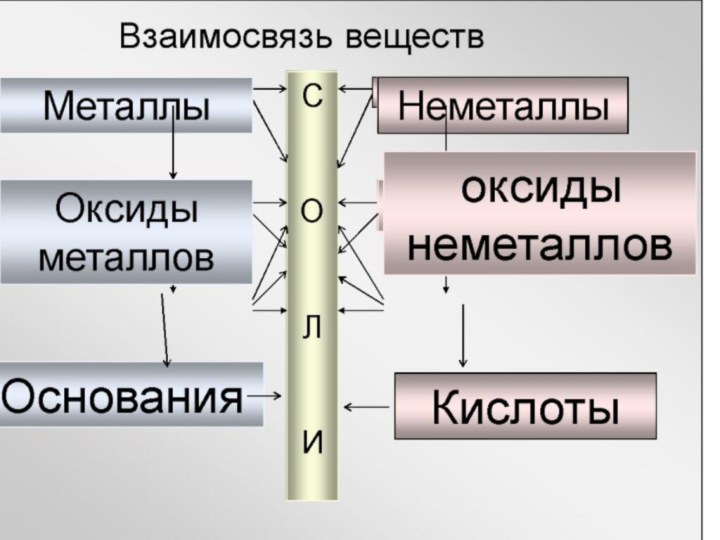
Генетическая связь между классами неорганических веществ
Характерные признаки генетических
рядов.
Все вещества должны быть образованы одним химическим элементом.
Br2 HBr NaBr AgBr Ag
2. Вещества, образованные одним и тем же химическим элементом , должны принадлежать к разным классам.
3. Вещества, образующие генетический ряд одного химического элемента , должны быть связаны взаимопревращениями.
Слайд 22
Генетический ряд металла
Cu → Cu O
→ Cu SO4
Генетический ряд неметалла
S → SO3 → H2SO4
Слайд 24
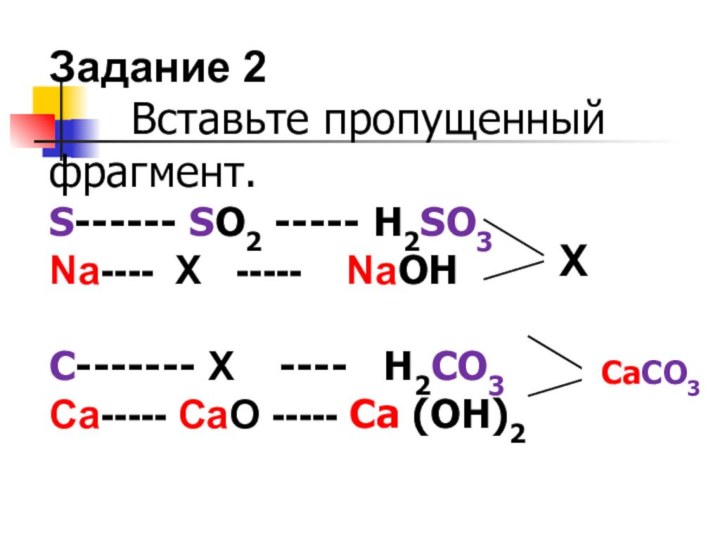
Задание 2
Вставьте пропущенный фрагмент.
S------ SО2
----- H2SO3
Na---- Х ----- NaОН
С------- Х
---- H2CO3
Ca----- CaO ----- Ca (OH)2
Х
ХХ
CaCO3
Слайд 25
проверка
S------ SО2 ----- H2SO3
Na----Na2O ----- NaОН
С ------- СО2 ---- H2CO3
Ca----- CaO ----- Ca (OH)2
Na2SO3
CaCO3
Слайд 26
Составьте схему генетической связи между веществами:
СОЛИ
NaCl
Fe
+2SO4
AlPO4
Ca(NO3)2
Cu+2CO3
Cr2+3S3
Na2SO4
Ba(NO3 )2
Слайд 29
НАЗОВИТЕ СОЛИ
NaCl -
хлорид натрия
Fe +2SO4 - сульфат железа (II)
Al3(PO4)3 – фосфат
алюминия
Ca(NO3)2 - нитрат кальция
Cu+2CO3 – карбонат меди (II)
Cr2+3S3 – сульфид хрома (III)
Na2SO4 – сульфат натрия
Ba(NO3 )2 - нитрат бария
Слайд 30
хлорида кальция
СаCl2
нитрата
натрия
NaNO3
Zn(SO4)2
Cu NO3
сульфата цинка
хлорида свинца (II)
нитрата меди (I)
PbCl2
Задание Составьте формулу
Слайд 31
Изменение окраски индикатора
Для кислот,
также как и для щелочей, существуют
качественные
реакции с помощью которых растворы
кислот можно распознать среди растворов других веществ.
Это реакции с индикаторами.
Слайд 32
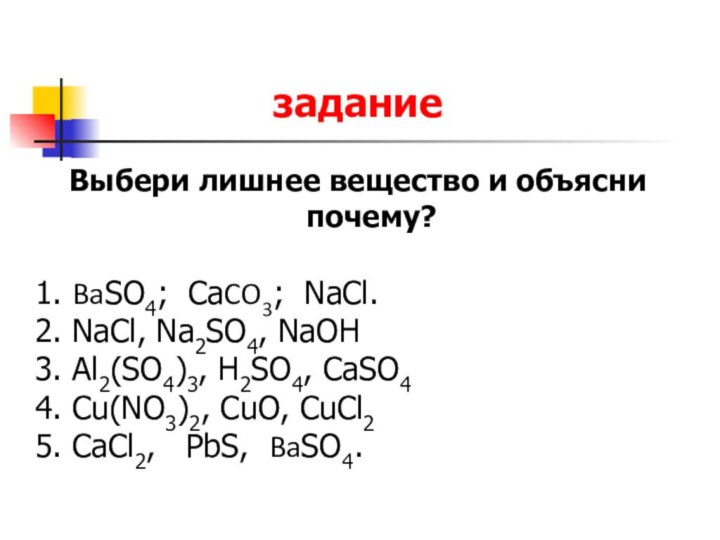
задание
Выбери лишнее вещество и объясни почему?
1. BaSO4; CaCO3; NaCl.
2. NaCl, Na2SO4, NaOH
3. Al2(SO4)3, H2SO4, CaSO4
4. Cu(NO3)2, CuO, CuCl2
5. CaCl2, PbS, BaSO4.
Слайд 33
Ответы
1. NaCl. т.к…
2.
NaOH т.к...
3 H2SO4, т.к…
4. CuO, т.к…
5. CaCl2 т.к…