- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по теме Серная кислота 9 класс
Содержание
- 2. Я растворю любой металл.Меня алхимик получалВ реторте
- 3. Объект исследования – серная кислотаКластер –прогноз:получениестроение↔свойства↔применениефизические химические
- 4. ρ = 1,84г/млСерная кислотаFeSO4 ∙ 7 H2O
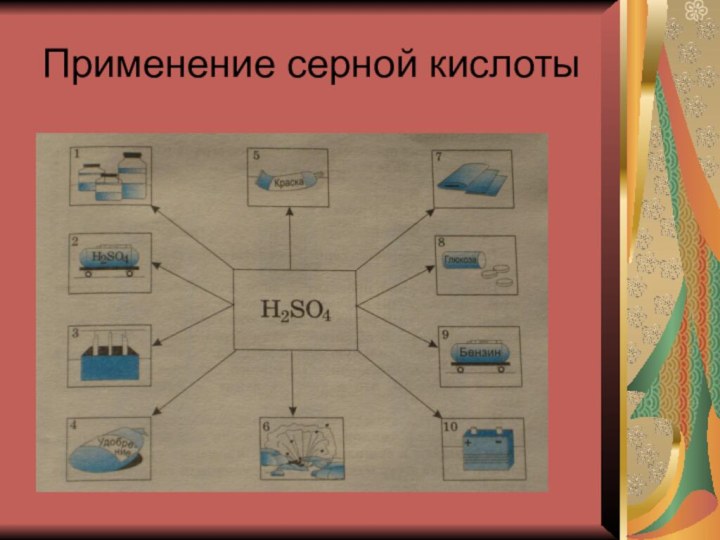
- 5. Применение серной кислоты
- 6. Общая характеристика и строение молекулы серной кислотыПо
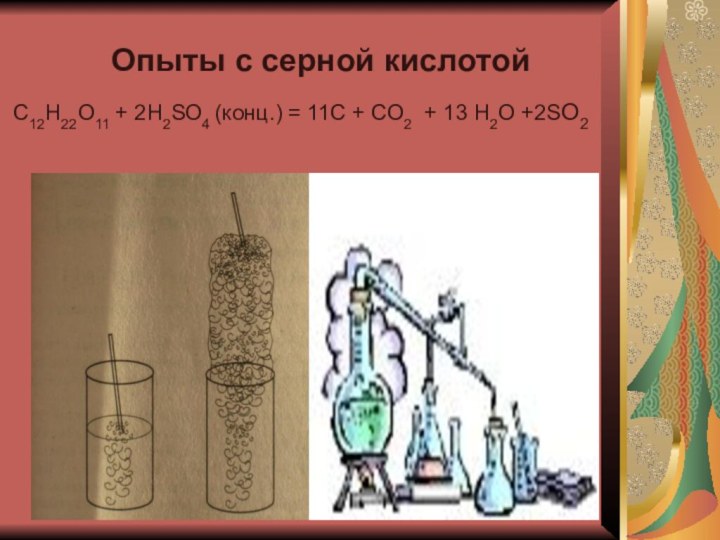
- 7. Опыты с серной кислотойС12H22O11 + 2H2SO4 (конц.)
- 8. Взаимодействие концентрированной серной кислоты с металламиCu +2H2SO4
- 9. Блюдо «Жаркое»Определите с какими веществами взаимодействует1 группа
- 10. 1 группа и 4 группа: раствор H2SO4
- 11. Вывод:Растворы кислот (соляной и серной) взаимодействуют:1. с
- 12. Название блюда? Рецепт: уравнения химических реакцийРеактивы:
- 13. Подведение итогов «Когда мы осмыслим свою роль
- 14. Ссылки на источники: 1.1.http://www.sigmatec.ru/main/prod/sernaya_kislota/nature2. http://dobavkam.net/dobavki/e5133. Учебник для общеобразовательных учреждений – 9 класс, О.С.Габриелян4. Википедия (электронная энциклопедия)
- 15. Скачать презентацию
- 16. Похожие презентации
Я растворю любой металл.Меня алхимик получалВ реторте глиняной простойСлыву я главной кислотой…Когда сама я растворяюсьВ воде, то сильно нагреваюсь.













Слайд 3
Объект исследования – серная кислота
Кластер –прогноз:
получение
строение↔свойства↔применение
физические химические
Слайд 4
ρ = 1,84г/мл
Серная кислота
FeSO4 ∙ 7 H2O =
H2SO4 + FeO + 6 H2O
Цель урока: рассмотреть и
изучить строение, свойства, применение серной кислоты
Слайд 6
Общая характеристика и строение молекулы серной кислоты
По основности:
двухосновная
По наличию кислорода: кислородсодер-
жащая
По силе: сильный электролит
Это тяжёлая жидкость,
которая в любом соотношении смешивается с водой, имеет молекулярную решётку и ковалентную полярную связь
Слайд 8
Взаимодействие концентрированной
серной кислоты с металлами
Cu +2H2SO4 (конц.)
= CuSO4+ SO2 + 2H2O
Cu0-2e-→Cu+2
*1S+6+2e-→S+4 *1
металл+H2SO4 (конц.)→сульфат +H2S + H2O
(до H2 в ряду или S
напряжений)
Слайд 9
Блюдо «Жаркое»
Определите с какими веществами взаимодействует
1 группа и
4 группа:
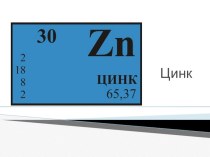
р-р H2SO4 : Zn, Hg, NaOH, HCl,
MgO2 группа и 5 группа:
р-р H2SO4 : Cu, Mg, ZnO, HNO3, K2CO3,
3 группа и 6 группа:
р-р H2SO4 : BaCl2, Ag, NaCl, Fe(OH)2, Na2O
Подчеркните формулы этих веществ. Напишите уравнения реакций в молекулярном виде, для одной из реакций составьте ионные уравнения.
Слайд 10
1 группа и 4 группа:
раствор H2SO4 :
Zn, Hg, NaOH, HCl, MgO
2 группа и 5 группа:
раствор H2SO4 : Cu, Mg, ZnO, HNO3, K2CO3,3 группа и 6 группа:
раствор H2SO4 : BaCl2, Ag, NaCl, Fe(OH)2, Na2O
Слайд 11
Вывод:
Растворы кислот (соляной и серной) взаимодействуют:
1. с металлами
до H2 в ряду напряжений металлов;
2. с основными и
амфотерными оксидами;3. с основаниями
4. с солями, если выделяется газ, вода или осадок
Слайд 12
Название
блюда?
Рецепт: уравнения химических реакций
Реактивы: растворы веществ: серная кислота,
хлорид бария, магний, оксид меди (II),соляная кислота, хлорид натрия,
карбонат натрия, нитрат бария, лакмус, метиловый оранжевый.Оборудование: пробирки, штативы, держатели, спиртовки, спички
Слайд 13
Подведение итогов
«Когда мы осмыслим свою роль на
земле, пусть самую скромную и незаметную, тогда лишь мы
будем счастливы» (Антуан де Сент- Экзюпери)