- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему к уроку Углерод.Аллотропия
Содержание
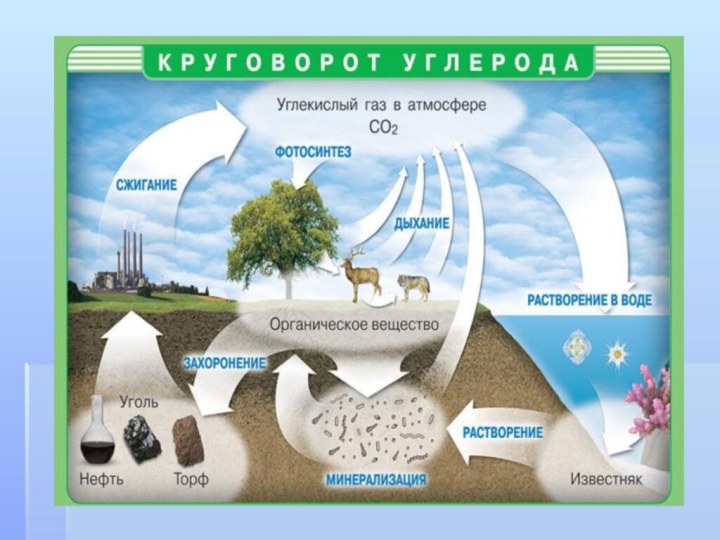
- 2. План урока:1.Характеристика элемента2.Углерод в природе3.Аллотропные видоизменения углерода4.Адсорбция5.Химические свойства6.Применение7.Круговорот углерода в природе
- 3. Тест по теме « Подгруппа азота» 1.
- 4. Тест по теме « Подгруппа азота» 6.Соли
- 5. Ответы1-3, 2-5, 3-2, 4-1,5-1, 6-3, 7-3,8-2, 9-4, 10-2
- 6. Характеристика химического элемента:Символ элементаПоложение в периодической системе
- 7. С№ 6, 2 период, IVA группа
- 8. Углерод в природе
- 9. Нахождение в природеВ атмосфереВ атмосфере и гидросфере
- 10. Аллотропия - это явление, при котором один
- 11. Аллотропные видоизменения углерода
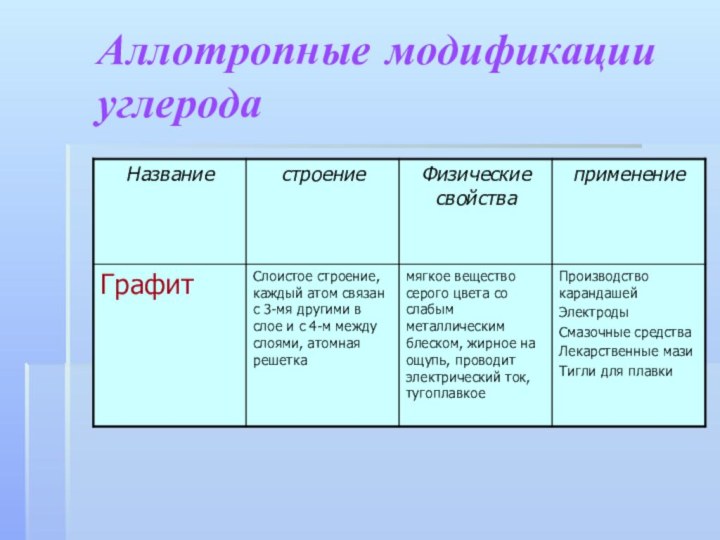
- 12. Аллотропные модификации углерода
- 13. алмазыСтроение Алмазы ЯкутииАлмазный фонд РоссииАлмазные сверла,шлифовальные инструменты
- 14. Аллотропные модификации углерода
- 15. графитстроениеУдилище из углепластикаТрубы из графитакарандашиГрафитовые электроды
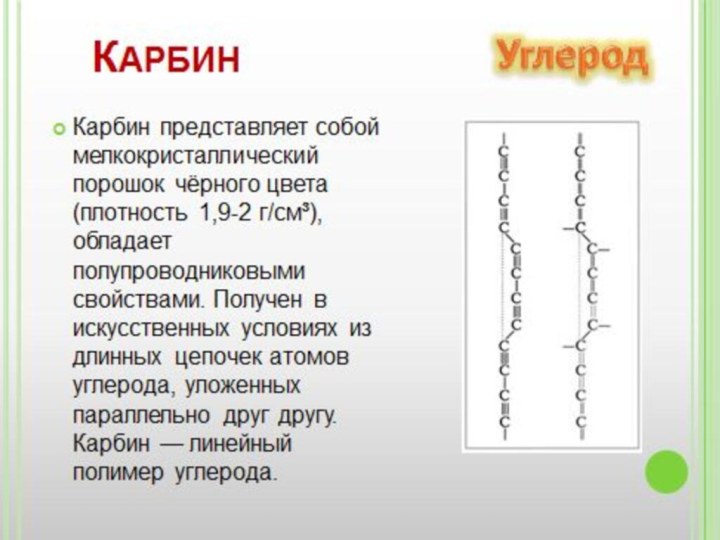
- 17. Фуллере́ны— молекулярные соединения, принадлежащие классу аллотропных форм
- 19. АдсорбцияАдсорбция – это явление, при котором происходит поглощение газов и растворенных веществ поверхностью твердого тела.
- 20. Адсорбция угольАктивированный угольпротивогазФильтры для воды
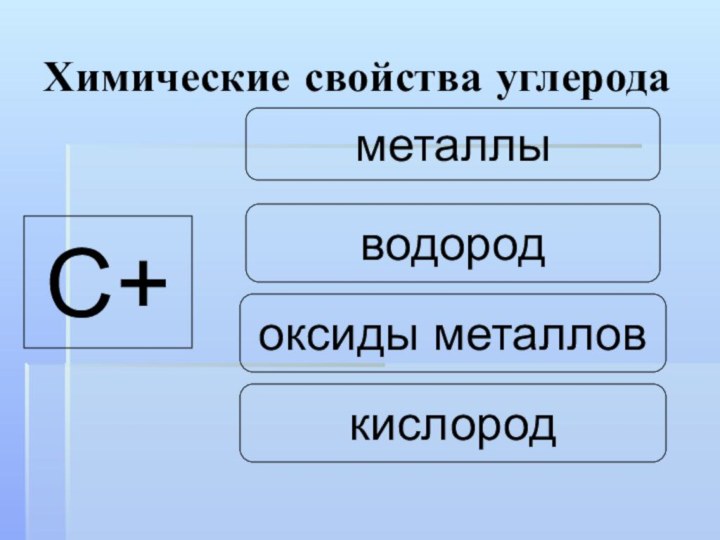
- 21. водородкислородоксиды металловметаллыС+ Химические свойства углерода
- 22. Химические свойства углеродаУглерод окислитель:А) с водородом С
- 24. 2. Углерод восстановитель:А)восстанавливает металлы из оксидовFe2O3 +
- 25. +3
- 26. Б) с кислородом углерод, в зависимости от
- 28. Ответы к тесту 2:1-В, 2- А,3-Д,4-А,5-С
- 30. Скачать презентацию
- 31. Похожие презентации
План урока:1.Характеристика элемента2.Углерод в природе3.Аллотропные видоизменения углерода4.Адсорбция5.Химические свойства6.Применение7.Круговорот углерода в природе


























Слайд 2
План урока:
1.Характеристика элемента
2.Углерод в природе
3.Аллотропные видоизменения углерода
4.Адсорбция
5.Химические
свойства
Слайд 3
Тест по теме « Подгруппа азота»
1. Число электронов
на внешнем энергетическом уровне атома азота
1)
7 2) 8 3) 5 4) 42.Максимальная степень окисления фосфора:
а) +1 б) +4 в) +3 г) +5
2. Степень окисления азота в соединениях NH3, соответственно равна
1) +2 2) -3 3) +3 4) 0
3. Формула высшего оксида азота
1) N2O3 2) N2O 3) N2O5 4) NO2
4. Тип химической связи в молекуле азота
1) ковалентная неполярная 2) ионная 3) ковалентная полярная
4) металлическая
5.Газ без цвета, запаха и вкуса, немного легче воздуха, малорастворим в воде:
1) азот 2) кислород 3) аммиак 4) бурый газ
Слайд 4
Тест по теме « Подгруппа азота»
6.Соли ортофосфорной кислоты
называются:
1) сульфаты 2)
нитраты 3) ортофосфаты 4) хлориды7.Верны ли следующие суждения о свойствах азотной кислоты?
А. Одноосновная, сильная, кислородосодержащая
Б. Концентрированная кислота взаимодействует со всеми металлами.
1) верно только А 2) верно только Б 3) верны оба суждения
4) оба суждения неверны
8.Какое из указанных веществ вступает в реакцию с оксидом фосфора?
сера 2. вода 3. оксид углерода( ) 4. оксид углерода(
9.Соли азотной кислоты называются:
1) сульфаты 2) хлориды 3) карбонаты 4) нитраты
10. Какой реактив необходим для определения, иона аммония:
1) HCl; 2) NaOH; 3)HNO3.
Слайд 6
Характеристика химического элемента:
Символ элемента
Положение в периодической системе химических
элементов
Строение атома:
заряд ядраколичество протонов
количество электронов
количество нейтронов
Электронная формула
Валентные возможности
Высший оксид элемента
Высший гидроксид элемента
Водородное соединение элемента
Слайд 7
С
№ 6, 2 период, IVA группа
N(p) = 6
N(e) = 6N(n) = 6
4.
5. II, IV
6. CO2
7. Н2СО3
8. СН4
Характеристика химического элемента углерод
+6C
1s2 2s22p2
Слайд 9
Нахождение в природе
В атмосфереВ атмосфере и гидросфере
находится
в виде диоксида углерода СО2,
в воздухе 0,046 % СО2
по массе, в водах рек, морей и океанов в ~60 раз больше.
Углерод входит в состав растений и животных (~18 %).
Общее содержание углерода в организме человека достигает около 21 % (15 кг на 70 кг массы тела).
Углерод составляет 2/3 массы мышц и 1/3 массы костной ткани
Слайд 10
Аллотропия
- это явление, при котором один
и тот же химический элемент может существовать в виде
нескольких простых веществСлайд 17 Фуллере́ны— молекулярные соединения, принадлежащие классу аллотропных форм углерода
и представляющие собой выпуклые замкнутые многогранники, составленные из чётного
числа трёхкоординированных атомов углерода. Своим названием эти соединения обязаны инженеру и дизайнеру Ричарду Бакминстеру Фуллеру.Углерод
ФУЛЛЕРЕН
Слайд 19
Адсорбция
Адсорбция – это явление, при котором происходит поглощение
газов и растворенных веществ поверхностью твердого тела.
Слайд 22
Химические свойства углерода
Углерод окислитель:
А) с водородом
С +
Н2 ?
Б) с металлами (образуются карбиды металлов)
Al + C
?Закончите уравнения реакций, рассмотрите
окислительно-восстановительный процесс
Слайд 23 0
0
-4 +С + 2Н2 ? СН4
0 +4ē -4
С ? С окислитель
0 -2ē +
Н2 ? 2Н восстановитель
0 0 +3 -4
4Al + 3C ? Al4C3
0 -3ē +3
Al ? Al восстановитель
0 +4ē -4
C ? C окислитель
1
2
3
4
Слайд 24
2. Углерод восстановитель:
А)восстанавливает металлы из оксидов
Fe2O3 + C
?
Закончите уравнение реакции (углерод
окисляется до +4), рассмотрите
окислительно- восстановительный процесс
Слайд 25 +3
-2
0 0 +4 -22Fe2O3 + 3C ? 4Fe + 3СО2
+3 +3ē 0
Fe ? Fe окислитель
0 -4ē +4
C ? C восстановитель
4
3
Слайд 26 Б) с кислородом углерод, в зависимости от условий
образует два оксида:
- оксид углерода (IV), (углекислый
газ) - оксид углерода (II), (угарный газ)
Составьте два уравнения взаимодействия
углерода с кислородом, рассмотрите
окислительно-восстановительные
процессы
Слайд 27
0
0 +4 -2С + О2 ? СО2
0 -4ē +4
С ? С восстановитель
0 +4ē -2
О2 ? 2О окислитель
0 0 +2 -2
2С + О2 ? 2СО
0 -2ē +2
С ? С восстановитель
0 +4ē -2
О2 ? 2О окислитель
1
1
2
1