- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Карбоновые кислоты. Для факультатива
Содержание
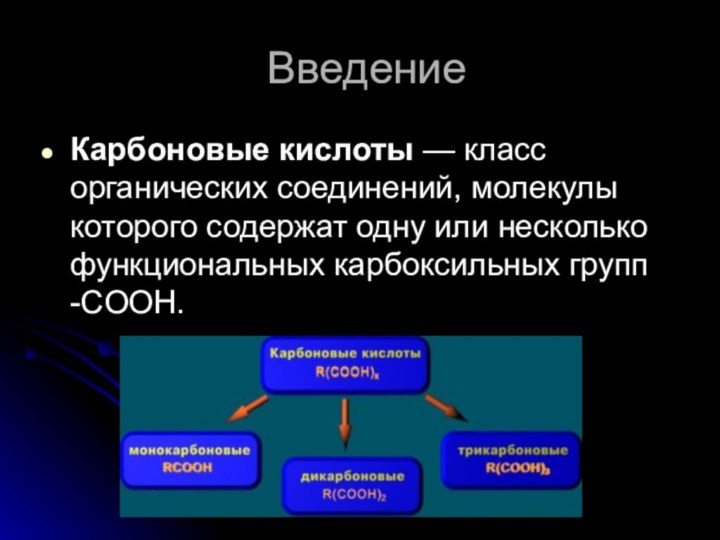
- 2. ВведениеКарбоновые кислоты — класс органических соединений, молекулы которого содержат одну или несколько функциональных карбоксильных групп -COOH.
- 3. Кислые свойства Кислые свойства объясняются тем,
- 4. Классификация В зависимости от радикала, связанного
- 5. Физические свойства Низшие карбоновые кислоты —
- 6. Характерные химические реакции Наиболее важные химические свойства,
- 7. Характерные химические реакции Также карбоновые кислоты
- 8. Скачать презентацию
- 9. Похожие презентации
ВведениеКарбоновые кислоты — класс органических соединений, молекулы которого содержат одну или несколько функциональных карбоксильных групп -COOH.







Слайд 2
Введение
Карбоновые кислоты — класс органических соединений, молекулы которого содержат
одну или несколько функциональных карбоксильных групп -COOH.
Слайд 3
Кислые свойства
Кислые свойства объясняются тем,
что данная группа может сравнительно легко отщеплять протон. За
редкими исключениями карбоновые кислоты являются слабыми.Дикарбоновые и трикарбоновые кислоты более сильные, чем монокарбоновые.
Слайд 4
Классификация
В зависимости от радикала, связанного
с карбоксилом, различают алифатические (предельные и непредельные), алициклические, ароматические
и гетероциклические карбоновые кислоты. По числу карбоксильных групп кислоты могут быть одно-, двух- и многоосновными.
Слайд 5
Физические свойства
Низшие карбоновые кислоты — жидкости
с острым запахом, хорошо растворимые в воде. С повышением
относительной молекулярной массы растворимость кислот в воде уменьшается, а температура кипения повышается. Высшие кислоты, начиная с пеларгоновой СН3-(СН2)7-СООН, — твердые вещества, без запаха, нерастворимые в воде. Низшие карбоновые кислоты в безводном виде и в виде концентрированных растворов раздражают кожу и вызывают ожоги, особенно муравьиная кислота и уксусная кислота.
Слайд 6
Характерные химические реакции
Наиболее важные химические свойства, характерные
для большинства карбоновых кислот:
1) Карбоновые кислоты при
реакции с металлами или их основными гидроксидами дают соли соответствующих металлов:2CH3COOH + Mg = (CH3COO)2Mg + H2
CH3COOH + NaOH = CH3COONa + H2O
Слайд 7
Характерные химические реакции
Также карбоновые кислоты могут
вытеснять более слабую кислоту из её соли, например:
CH3COOH + NaHCO3 = CH3COONa + H2CO3 2) Карбоновые кислоты в присутствии кислого катализатора реагируют со спиртами, образуя сложные эфиры:CH3COOH + СН3СН2ОН = CH3COOCH2СН3 + H2O