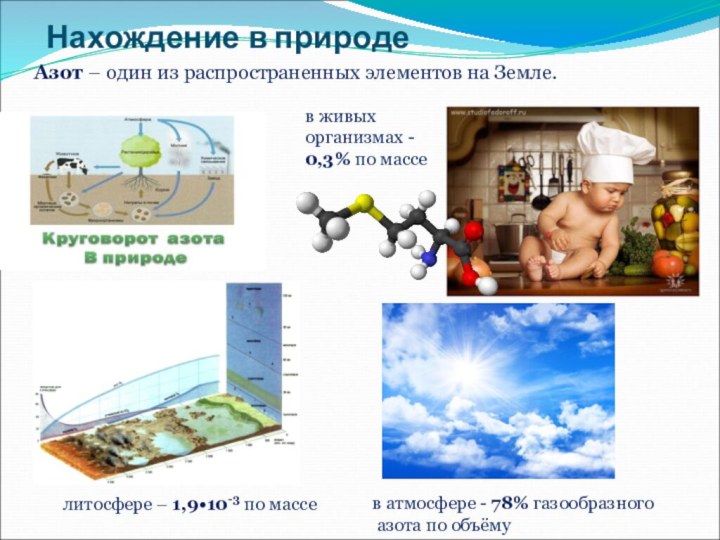
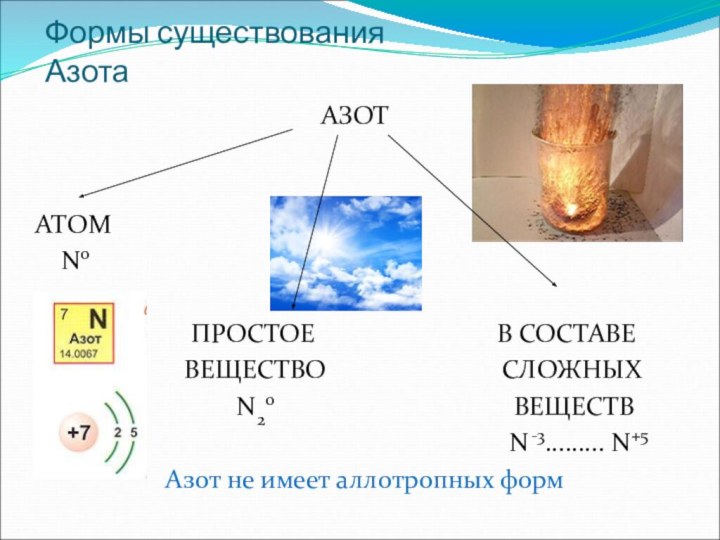
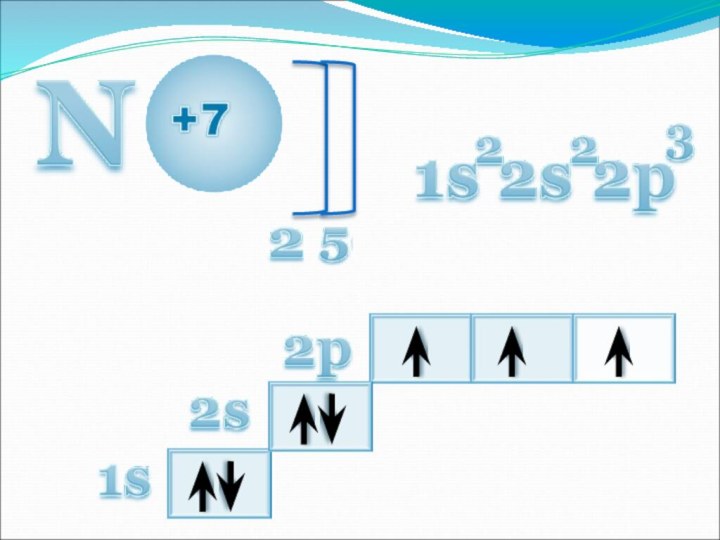
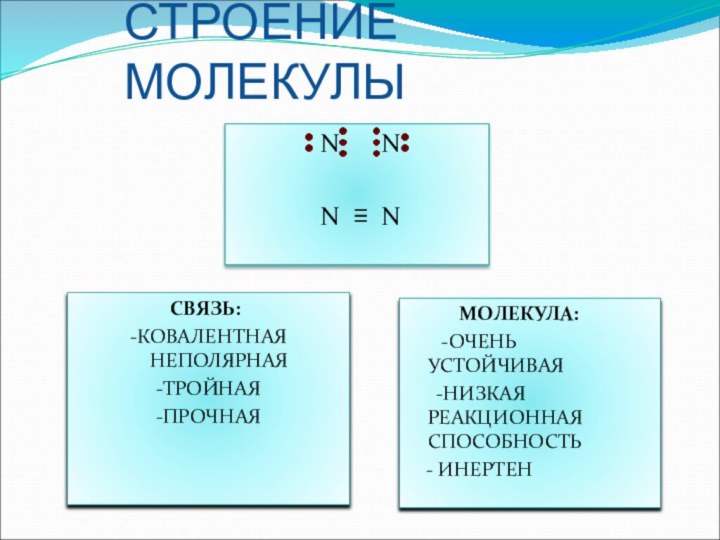
жизни на Земле.
Цели урока:
Повторить и закрепить знания
учащихся по строению атома и молекулы азота.Изучить физические и химические свойства простого вещества азота.
Раскрыть роль азота в природе.