Кислоты
Кислотами называются сложные вещества, молекулы
которых состоят из атомов водорода и кислотных остатков.
Кислоты- кислые на вкус.
В природе кислоты встречаются очень часто и они вам хорошо известны ,те кислоты которые содержатся в пищевых продуктах называют пищевыми, их можно пробовать на вкус.
Слайд 3
Яблочная кислота – в яблоках и ревене
Слайд 4
Лимонная кислота – в лимонах
Слайд 5
Кислый вкус листьев щавеля, шпината и томатов обусловлен
щавелевой кислотой
Слайд 6
Молочная кислота образуется в мышцах, при скисании
молока, квашении капусты и силосовании кормов.
Слайд 7
Уксусная кислота – в уксусе и при
скисании виноградного вина.
Слайд 8
Винная кислота – в винограде
Слайд 9
Муравьиная кислота – в яде муравьев и пчел,
в жгучих волосках крапивы.
Слайд 10
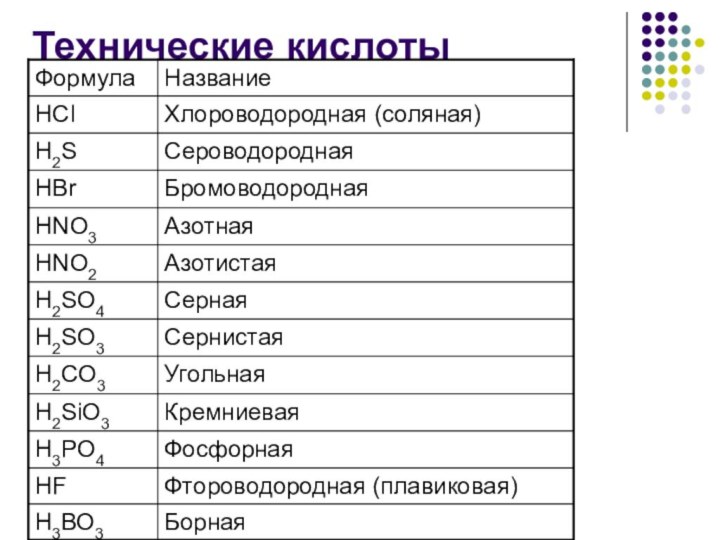
Кроме природных кислот, существуют и такие, которые получают
промышленным путем для использования их в производстве и в
лабораториях (например, серная и соляная кислоты).
Кислоты могут быть как в жидком, так и в твердом агрегатном состоянии.
Жидкие кислоты:
серная кислота
азотная кислота
хлороводородная (соляная) кислота…
Слайд 11
Твердые кислоты: лимонная кислота, пальмитиновая кислота, борная кислота
и другие.
Слайд 13
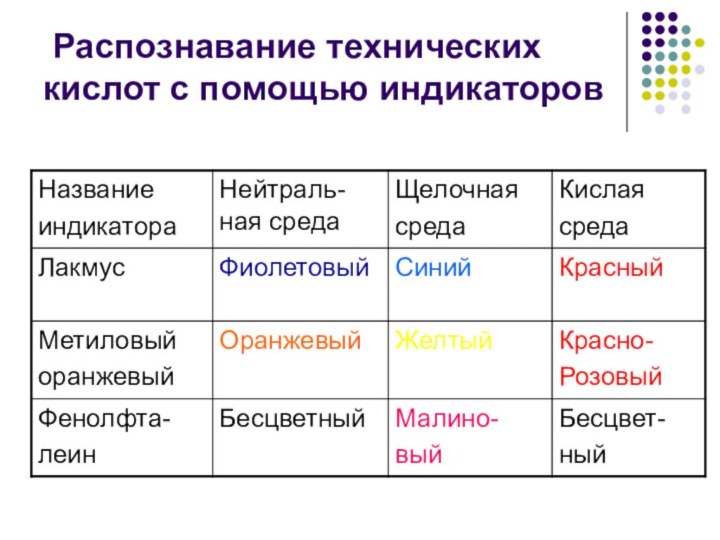
Распознавание технических кислот с помощью индикаторов
Слайд 15
Кислоты образуют ионы двух видов:
Простые – ионы водорода
Н + (катионы)
Сложные – ионы кислотного остатка
(анионы), которые имеют отрицательный заряд, равный основности кислоты (количеству атомов водорода в кислоте)
HCl – H+ Cl-
H2SO4 – H2+SO42-
H3PO4 - H3+ PO43-
Слайд 16
Химическая формула серной кислоты – H2SO4.
Плотность серной кислоты
– 1,84 г /см3,плотность воды – 1 г /см3.
Концентрированная
серная кислота – это бесцветная маслянистая жидкость, без запаха, примерно в два раза тяжелее воды.
Слайд 17
Концентрированная серная кислота разрушает ткани,
Слайд 20
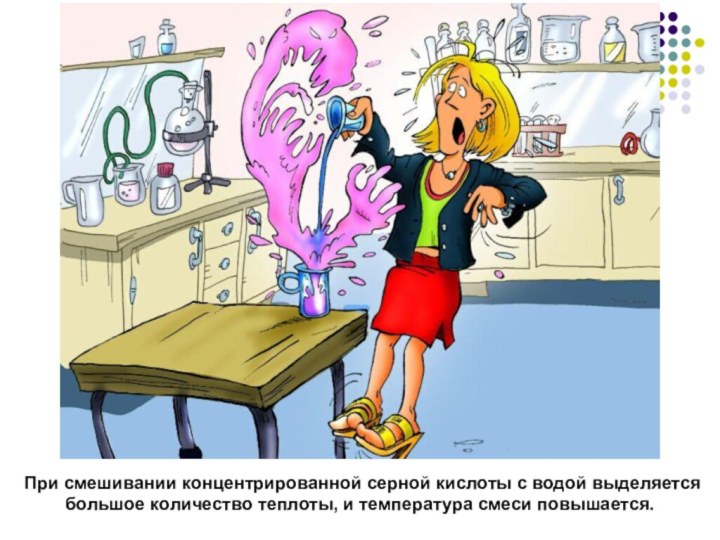
При смешивании концентрированной серной кислоты с водой
выделяется большое количество теплоты, и температура смеси повышается.
Слайд 21
При разбавлении концентрированной серной кислоты всегда соблюдайте следующее
правило: сначала вода, а потом кислота, иначе случится большая
беда!
Слайд 22
Соляная кислота
Несколько тяжелее воды.
Содержится в желудке и выполняет
две функции:
1) Уничтожает микробов, которые попадают в
желудок вместе с пищей.
2) Помогает перевариванию пищи, так как входит в состав желудочного сока.
Слайд 23
Хлороводородная (соляная) кислота HCl – бесцветная жидкость. Она
имеет запах хлороводорода. Соляная кислота ”дымит” на воздухе –
это является её характерным свойством.
Слайд 24
Хлороводородная кислота – едкое вещество, она повреждает ткань,
бумагу и древесину. При попадании на кожу вызывает ожоги.
Слайд 25
Способы получения кислот
Взаимодействие кислотных оксидов с водой (только
кислородсодержащие кислоты):
SO3 + H2O = H2SO4 (серная кислота)
P2O5 +
3H2O = 2H3PO4 (ортофосфорная кислота)
CO2 + H2O = H2CO3 (угольная кислота)
Слайд 26
Взаимодействие водорода с соответствующими неметаллами (для бескислородных кислот)
с последующим растворением в воде:
H2 + CI2 = 2HCI
H2
+ S = H2S
H2 + Br2 = 2HBr
Взаимодействие кислот с солями:
2NaCI + H2SO4= Na2SO4 + 2HCI
Слайд 27
Запомни
Валентность кислотного остатка определяется по числу атомов
водорода в кислоте:
HCl - I
H2S – II
H2SO4 -
II
H3PO4 - III
HNO3 - I
Слайд 28
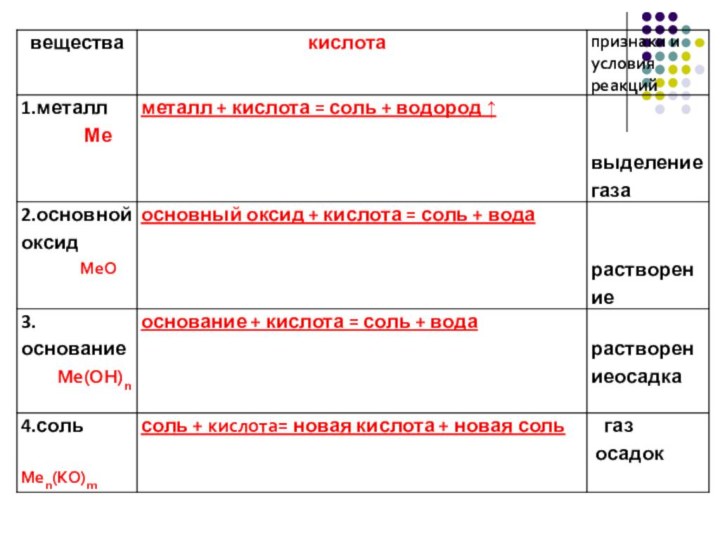
Химические свойства кислот
1) Водные растворы изменяет окраску индикаторов.
2)
Взаимодействуют с металлами (до водорода, исключение HNO3) с образованием
соли и водорода:
Zn + 2HCI = ZnCI2 + H2
Mg + H2SO4 = MgSO4 + H2
2AI + 3H2SO4 = AI2(SO4)3 + 3H2
2AI + 6HCI = 2AICI3 + 3H2
Слайд 29
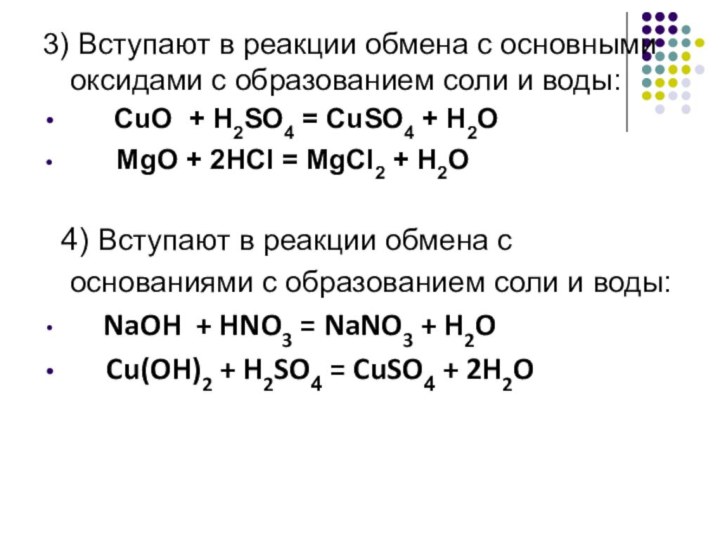
3) Вступают в реакции обмена с основными оксидами
с образованием соли и воды:
CuO +
H2SO4 = CuSO4 + H2O
MgO + 2HCl = MgCl2 + H2O
4) Вступают в реакции обмена с основаниями с образованием соли и воды:
NaOH + HNO3 = NaNO3 + H2O
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
Слайд 30
5) Вступают в реакции обмена с солями с
образованием новой соли и новой кислоты (при условии если
один из продуктов реакции выпадает в осадок или выделяется в виде газа):
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
BaCl2 + H2SO4 = BaSO4 + 2HCl
Слайд 32
Характеристика кислоты
Формула
Наличие кислорода
Основность (число атомов водорода)
Растворимость
Валентность элементов, образующих
кислоту.
Заряд иона кислотного остатка
Соответствующий оксид
Задание
Дайте характеристику следующим кислотам согласно плану
Азотистой
Кремниевой
Соляной
Бромоводородной
Сернистой
Какому количеству вещества соответствует 126 граммов азотной кислоты?
Какова масса
3 моль серной кислоты?
Сколько молекул содержится в 49 граммах фосфорной кислоты?