Слайд 2
Цель урока: сформировать понятие ионная химическая связь.
Задачи урока:
Изучить
виды химической связи в теме «строение вещества», на данном
уроке разобрать причины и механизмы образования ионной связи.
Познакомить: с типами ионных кристаллических решеток; с физическими свойствами веществ кристаллических решеток.
Знать основные понятия: химическая связь, ионная химическая связь, ионные кристаллические решетки.
Уметь определять ионную связь.
Слайд 3
Тип урока: изучение нового материала.
Этапы урока:
Организационный момент: поставить
цели и задачи урока.
Изучение нового материала.(см. слайды)
Закрепление нового материала.
Слайд 4
Химическая связь
Это взаимодействие атомов, которое связывает их в
молекулы, ионы, радикалы, кристаллы.
4 типа химических связей:
Ионная
Ковалентная
Металлическая
Водородная
Слайд 5
Ионная химическая связь
Это связь, образовавшаяся за счет электростатического
притяжения катионов к анионам.
Главный закон химической реакции - заполнение
валентного энергетического уровня.
Когда валентный энергетический уровень заполнен - элемент становится стабильным или насыщенным.
Слайд 6
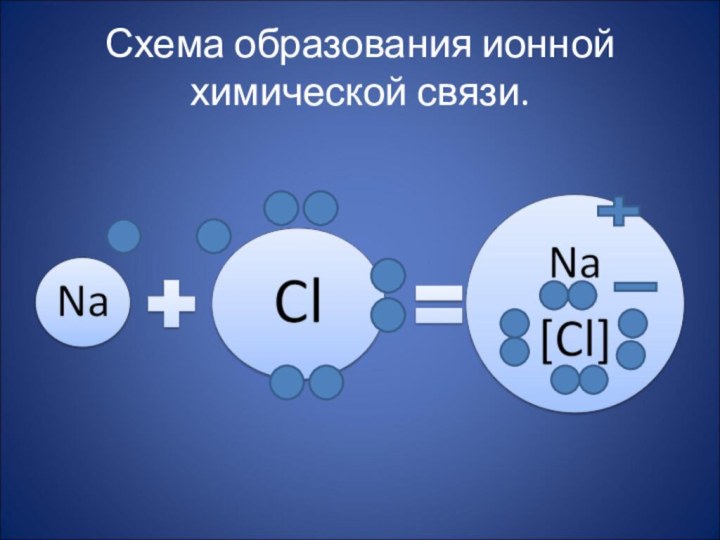
Схема образования ионной связи в хлориде натрия.
Натрий -
Na, щелочной металл (группа IA).
Электронная конфигурация:
1s22s22p63s1
Как видим, натрий имеет один валентный электрон, который он "согласен" отдать, чтобы его энергетические уровни стали завершенными.
Слайд 7
Схема образования ионной связи в хлориде натрия.
Хлор -
Cl, галоген (группа VIIA).
Электронная конфигурация:
1s22s22p63s23p5
Как видим, хлор имеет 7 валентных электронов и ему "не хватает" одного электрона, чтобы его энергетические уровни стали завершенными.
Слайд 8
почему "дружны" атомы хлора и натрия?
Слайд 9
Схема образования ионной химической связи.
Слайд 10
Натрий Na
На внешнем энергетическом уровне атома натрия
находится один электрон. Для перехода в стабильное состояние, натрий
должен: отдать этот электрон, у него "исчезает" 3s-орбиталь, а количество протонов (11) будет на один превосходить количество электронов (10). Поэтому, нейтральный атом натрия превратится в положительно заряженный ион - катион.
Электронная конфигурация катиона натрия:
Na+ 1s22s22p6
Такая же электронная конфигурация и у неона (Ne).
Слайд 11
Так что же, натрий превратился
в неон?
Вовсе нет -
не забывайте о протонах!
Их по-прежнему; у натрия - 11; у неона - 10. Говорят, что катион натрия является изоэлектронным неону (поскольку их электронные конфигурации одинаковы).
Слайд 12
Натрий Na
Подведем итог:
атом натрия и его
катион отличаются одним электроном;
катион натрия имеет меньший размер,
поскольку он теряет внешний энергетический уровень.
Слайд 13
Хлор Cl
У хлора ситуация прямо противоположная -
на внешнем энергетическом уровне у него находится семь валентных
электронов и ему надо принять один электрон, чтобы стать стабильным.
Слайд 14
Хлор Cl
Подведем итог:
атом хлора примет один электрон
и станет отрицательно заряженным анионом
(17 протонов и 18 электронов);
электронная конфигурация хлора:
Cl- 1s22s22p63s23p6
анион хлора является изоэлектронным аргону (Ar);
поскольку внешний энергетический уровень хлора "достроился", то радиус катиона хлора будет немного больше, чем у "чистого" атома хлора.
Слайд 15
В результате перемещения электрона образуются ионы: катион натрия
(Na+) и анион хлора (Cl-). Поскольку противоположные заряды притягиваются,
то образуется устойчивое соединение NaCl (хлорид натрия) - поваренная соль.
соли образуются по аналогичному принципу, что и хлорид натрия.
Металл отдает электроны, а неметалл их получает.
Из периодической таблицы видно, что: элементы группы IA (щелочные металлы) отдают один электрон и образуют катион с зарядом 1+;
элементы группы IIA (щелочноземельные металлы) отдают два электрона и образуют катион с зарядом 2+;
элементы группы IIIA отдают три электрона и образуют катион с зарядом 3+;
Слайд 17
Анионы
элементы группы
VIIA (галогены) принимают один электрон и образуют анион с
зарядом 1-;
элементы группы VIA принимают два электрона и образуют анион с зарядом 2-;
элементы группы VA принимают три электрона и образуют анион с зарядом 3-;
Слайд 18
Пример катионов
Li+
Катион лития
Na+ Катион натрия
K+
Катион калия
Be2+ Катион бериллия
Mg2+ Катион магния
Ca2+ Катион кальция
Sr2+ Катион стронция
Ba2+ Катион бария
Слайд 19
Пример анионов
F-
Анион фтора
Cl- Анион хлора
Br- Анион брома
I-
Анион йода
O2- Анион кислорода
S2- Анион серы
Слайд 20
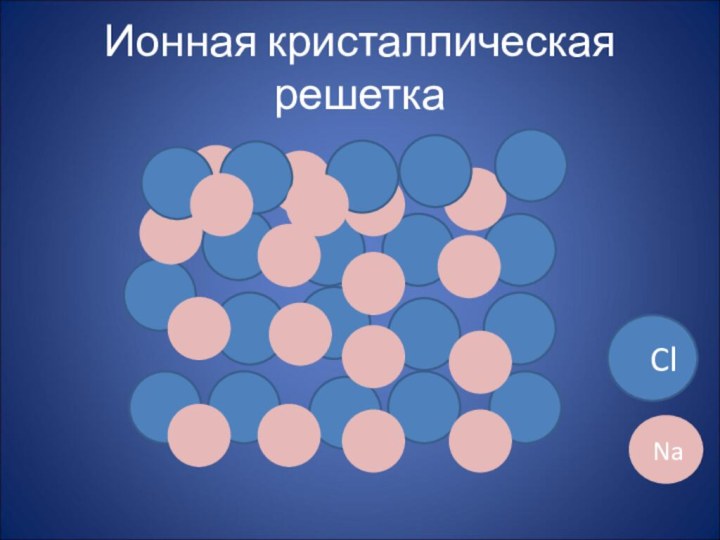
Ионная кристаллическая решетка
Cl
Na
Слайд 21
Ионная кристаллическая решетка
В кристалле хлорида натрия нельзя выделить
отдельные молекулы соли. Их нет. Весь кристалл следует рассматривать
как гигантскую макромолекулу, состоящую из равного числа ионов Na+ и Cl-, NanCln, где n - большое число . Связи между ионами в таком кристалле весьма прочны. Поэтому вещества с ионной решеткой обладают сравнительно высокой твердостью. Они тугоплавки и малолетучи.
Слайд 22
Ионная кристаллическая решетка
Плавление ионных кристаллов приводит к нарушению
геометрически правильной ориентации ионов относительно друг друга и уменьшению
прочности связи между ними. Поэтому расплавы их проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде.
Слайд 23
Ионная кристаллическая решетка
Кальцит CaCO3
Галенит PbS
Галит NaCl
Слайд 24
Найди ионную связь
ALBr3
Cl2
KI
NH3
HCl
CaC2
Mg
RbH
ПРАВИЛЬНО!!!