Слайд 2
Цели урока:
Закрепить полученные знания об одноатомных спиртах.
Познать
новое (многоатомные спирты) в сравнении с одноатомными, найти в
общем частное, в частном общее.
Сформировать представления учащихся о многоатомных спиртах
Познакомить с особенностями свойств многоатомных и одноатомных спиртов
Подчеркнуть связь количественных изменений с качественными
Закрепить знания общих свойств и способов получения спиртов
Слайд 3
Содержание урока:
1 этап - Организационно-мотивационный
Повторение предыдущей темы:
Устный
опрос
Работа на местах
Слайд 4
Устный опрос :
Какие вещества называются спиртами?
Слайд 5
Определение
Спирты́ (устаревшее алкого́ли) — органические соединения, содержащие
одну или несколько гидроксильных групп (гидроксил, OH),непосредственно связанных с
атомом углерода в углеводородном радикале.
Общая формула спиртов СnH2n-1OH
Слайд 6
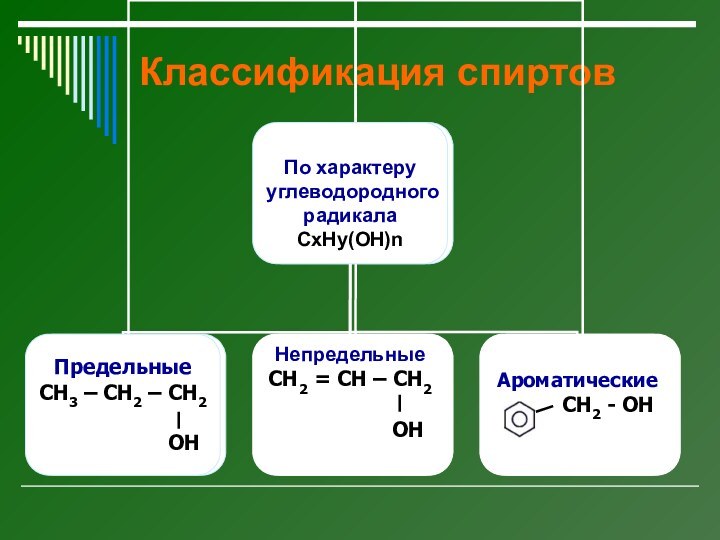
Как классифицируют спирты по числу ОН-групп, и по
Rad?
Слайд 10
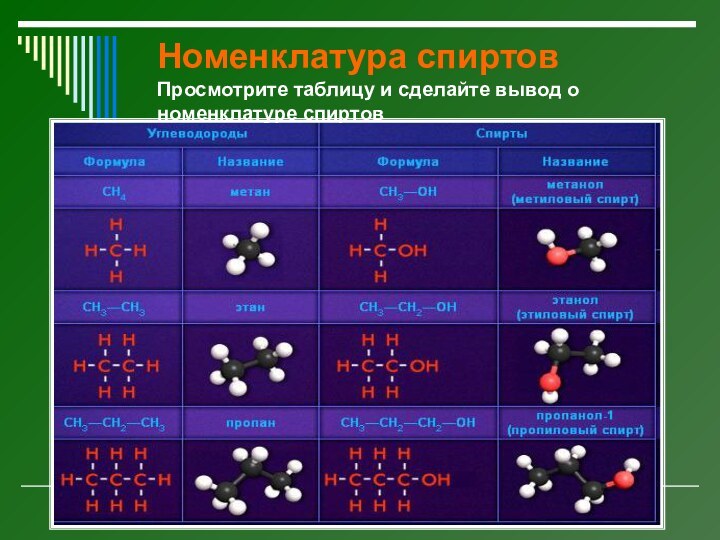
Номенклатура спиртов
Просмотрите таблицу и сделайте вывод о номенклатуре
спиртов
Слайд 11
Работа на местах
написать формулу
2-метил бутанола
2-метил-2-бутанола
Осуществить превращение:
C2 H6 → C2
H4 → C2 H5 O H → C2 H5 CI
↓
C2 H4
Слайд 13
Дать название следующим веществам:
CH2—CH—CH2—CH2—OH
I
CH3
CH3
⏐
OH--- CH 2—C--- CH3
⏐
CH3
Слайд 14
Характерные химические свойства спиртов?
Слайд 16
Отдельные представители спиртов
Слайд 18
Одноатомный спирт - метанол
Жидкость без цвета с температурой
кипения 64С, характерным запахом Легче воды. Горит бесцветным пламенем.
Применяется
в качестве растворителя и
топлива в ДВС
Слайд 19
Метанол - яд
Ядовитое действие метанола основано на поражении
нервной и сосудистой системы. Приём внутрь 5—10 мл метанола
приводит к тяжёлому отравлению, а 30 мл и более — к смерти.
Слайд 20
Одноатомный спирт - этанол
Бесцветная жидкость с характерным запахом
и жгучим вкусом, температурой кипения78С. Легче воды. Смешивается с
ней в любых отношениях.
Легко воспламеняется, горит слабо светящимся голубоватым пламенем.
Слайд 21
Применение этанола
Этиловый спирт употребляется при приготовлении различных
спиртных напитков.
В медицине для приготовления экстрактов из лекарственных
растений, а также для дезинфекции.
В косметике и парфюмерии этанол — растворитель для духов и лосьонов.
Слайд 22
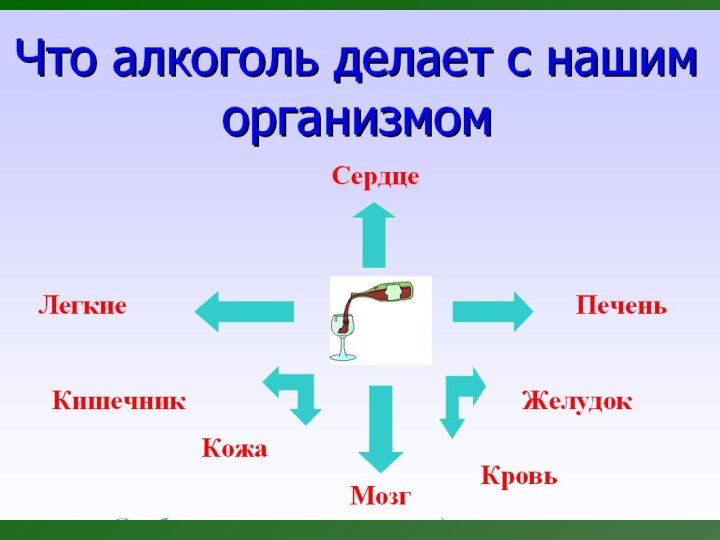
Вредное воздействие этанола
В начале опьянения страдают структуры
коры больших полушарий; активность центров мозга, управляющих поведением, подавляется:
утрачивается разумный контроль над поступками, снижается критическое отношение к себе. И. П. Павлов называл такое состояние «буйством подкорки».
При очень большом содержании алкоголя в крови угнетается активность двигательных центров мозга, главным образом страдает функция мозжечка - человек полностью теряет ориентацию.
Слайд 23
Вредное воздействие этанола
Изменения структуры мозга, вызванные многолетней алкогольной
интоксикацией, почти необратимы, и даже после длительного воздержания от
употребления спиртных напитков они сохраняются. Если же человек не может остановиться, то органические и, следовательно, психические отклонения от нормы идут по нарастающей.
Слайд 24
Вредное воздействие этанола
Алкоголь крайне неблагоприятно влияет на сосуды
головного мозга. В начале опьянения они расширяются, кровоток в
них замедляется, что приводит к застойным явлениям в головном мозге. Затем, когда в крови помимо алкоголя начинают накапливаться вредные продукты его неполного распада, наступает резкий спазм, сужение сосудов, развиваются такие опасные осложнения, как мозговые инсульты, приводящие к тяжелой инвалидности и даже смерти.
Слайд 25
Этиловый спирт является мощным наружным антисептиком и надежным
консервантом.
Легко понять: если вещество вызывает моментальное прекращение жизни и
гибель микробов, то такое же действие оно окажет на наш организм.
Слайд 26
Всем известно, что в этиловом спирте десятилетиями сохраняются
биологические структуры(кусочки тканей, органы)
Это возможно только потому, что все
процессы жизнедеятельности в спирте прекращаются
Слайд 27
В водке, коньяке, роме, вине, пиве, одеколоне, денатурате
основным фармакологически активным веществом, определяющим привлекательность этих жидкостей, является
этиловый спирт.
Слайд 28
При употреблении алкоголя мышление нарушается!
Несовместимость между антисептическим действием
и применением внутрь в качестве пищевого продукта люди не
осознают!
Смерть человека наступает при концентрации этанола в крови - 5 граммов на 1 литр крови.
Слайд 29
Этиловый спирт попадает во все органы и ткани!!!
Вследствие
этого при опьянении неизбежно нарушается работа всех клеток и
органов любого человека.
Слайд 31
Ведь раб не тот, кто стонет под кнутом,
Не
тот отшельник, кто по воле неба,
Живет в уединении глухом,
И
нищ не тот, кто просит корку хлеба.
И тот и раб, и нищ, и одинок,
Кто в жизни выбрал спутником порок
Слайд 32
МОТИВАЦИЯ к восприятию нового матерала:
Что мы знаем
о многоатомных спиртах? Используем ли их в повседневной жизни?
Как
вы думаете,что представляет собой глицерин?
Что вы знаете о незамерзающих жидкостях?
Давайте сегодня поговорим о них
Строение и физические свойства многоатомных спиртов
Химические свойства многоатомных спиртов
Применение спиртов.
Лабораторный опыт
Слайд 33
Представители:
Этиленгликоль
Глицерин
Ксилит
Сорбит
Слайд 34
Многоатомный спирт -этиленгликоль
Этиленгликоль — представитель предельных двухатомных спиртов
— гликолей.
Название гликоли получили вследствие сладкого вкуса многих
представителей ряда (греч. «гликос» — сладкий).
Этиленгликоль - сиропообразная жидкость сладкого вкуса, без запаха, ядовит. Хорошо смешивается с водой и спиртом, гигроскопичен.
Слайд 35
Этиленгликоль - яд
Дозы вызывающие смертельное отравление этиленгликолем
варьируются в широких пределах - от 100 до 600
мл. По данным ряда авторов смертельной дозой для человека является 50-150 мл. Смертность при поражении этиленгликолем очень высока и составляет более 60% всех случаев отравления.
Механизм токсического действия этиленгликоля до настоящего времени изучен недостаточно. Этиленгликоль быстро всасывается (в том числе через поры кожи) и в течение нескольких часов циркулирует в крови в неизмененном виде, достигая максимальной концентрации через 2-5 часов. Затем его содержание в крови постепенно снижается, и он фиксируется в тканях.
Слайд 36
Многоатомный спирт - глицерин
Глицерин – трехатомный предельный спирт.
Бесцветная, вязкая, гигроскопичная, сладкая на вкус жидкость. Смешивается с
водой в любых отношениях , хороший растворитель. Реагирует с азотной кислотой с образованием нитроглицерина. С карбоновыми кислотами образует жиры и масла.
Слайд 37
Отдельные представители спиртов
Слайд 40
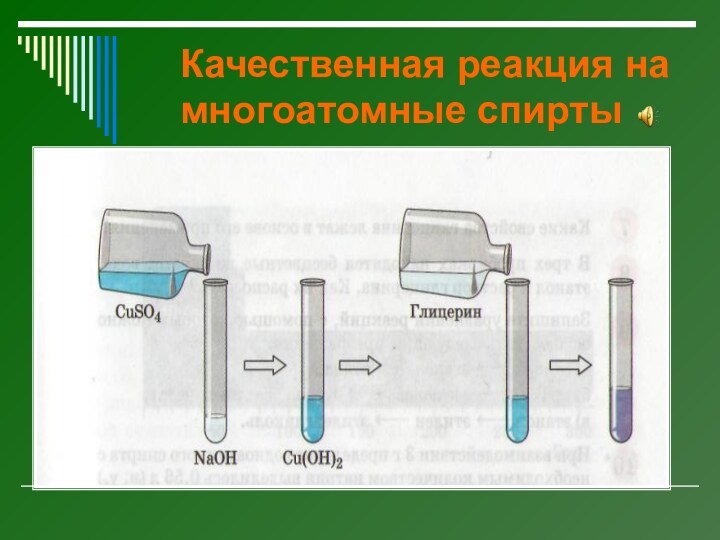
Качественная реакция на многоатомные спирты
Слайд 42
Качественная реакция на многоатомные спирты
Реакцией на многоатомные спирты
является их взаимодействие со свежеполученным осадком гидроксида
меди (II), который растворяется с образованием яркого сине-фиолетового раствора.
Слайд 43
Применение этиленгликоля
Важным свойством этиленгликоля является способность понижать температуру
замерзания воды, от чего вещество нашло широкое применения как
компонент автомобильных антифризов и незамерзающих жидкостей.
Он применяется для получения лавсана (ценного синтетического волокна).