- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Общая характеристика неметаллов, 9 класс
Содержание
- 2. НЕМЕТАЛЛЫ- ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ ,У КОТОРЫХ НА ПОСЛЕДНЕМ ЭНЕРГИТИЧЕСКОМ УРОВНЕ НАХОДИТСЯ ОТ 4 ДО 8 ЭЛЕКТРОНОВСЛОВАРЬ
- 3. R2OROR2O3RO2R2O5RO3R2O7RH4RH3H2RHRВысшие оксидыЛВСНеметаллы в природе98,5% от массы растений97,6%
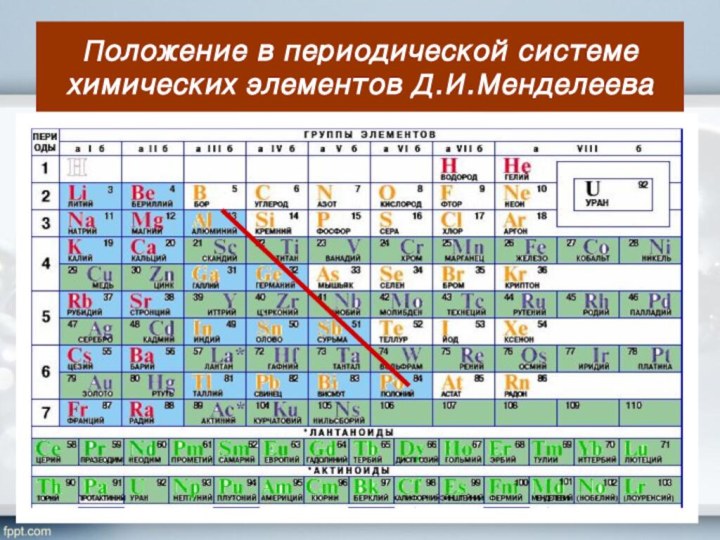
- 4. Положение в периодической системе химических элементов Д.И.Менделеева
- 5. Положение в периодической системе химических элементов Д.И.Менделеева
- 6. Положение в периодической системе химических элементов Д.И.Менделеева
- 7. Положение в периодической системе химических элементов Д.И.Менделеева
- 8. Особенности атомного строения неметаллов Небольшой атомный радиусНа
- 9. Электроотрицательность – это свойство атомов химических элементов
- 10. ФИЗИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ
- 11. Агрегатное состояние Газы ЖидкиеТвердые Br2I2, P4, C, Si, B, S8
- 12. Цвет неметалловКРАСНЫЙЖЕЛТЫЙФИОЛЕТОВЫЙФОСФОРСЕРАЙОДБЕСЦВЕТНЫЙУГЛЕРОД
- 13. В чем причина разнообразия физических свойству неметаллов ?
- 14. Такое разнообразие свойств являетсяследствием образования неметалламидвух типов
- 15. Физические свойства неметаллов> Tºпл Tºкип< Tºпл TºкипЙодвозгонкаН2ОН2О
- 16. Аллотро́пия (от др-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и
- 17. Причины аллотропии:Разные типы кристаллических решеток (белый фосфор
- 18. Элементарный фосфор в обычных условиях представляет собой
- 19. Ромбическая (a - сера) - S8t°пл. =
- 20. Скачать презентацию
- 21. Похожие презентации
НЕМЕТАЛЛЫ- ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ ,У КОТОРЫХ НА ПОСЛЕДНЕМ ЭНЕРГИТИЧЕСКОМ УРОВНЕ НАХОДИТСЯ ОТ 4 ДО 8 ЭЛЕКТРОНОВСЛОВАРЬ



















Слайд 2 НЕМЕТАЛЛЫ- ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ ,У КОТОРЫХ НА ПОСЛЕДНЕМ ЭНЕРГИТИЧЕСКОМ
УРОВНЕ НАХОДИТСЯ ОТ 4 ДО 8 ЭЛЕКТРОНОВ
Слайд 3
R2O
RO
R2O3
RO2
R2O5
RO3
R2O7
RH4
RH3
H2R
HR
Высшие оксиды
ЛВС
Неметаллы в природе
98,5% от массы растений
97,6% от
массы человека
49% кислород, 27% кремний от массы земной коры
O2;
N2; CO2; Н2О
период
Слайд 8
Особенности атомного строения неметаллов
Небольшой атомный радиус
На внешнем
уровне 4-8 электронов
Располагаются только в главных подгруппах
Характерно высокое значение
ЭОСлайд 9 Электроотрицательность – это свойство атомов химических элементов поляризовать
химическую связь, оттягивать к себе общие электронные пары (мера
неметалличности, т.е. чем более электроотрицателен данный химический элемент, тем ярче выражены неметаллические свойства). H Si P C S Br Cl N O F
у с и л е н и е ЭО
Слайд 14
Такое разнообразие свойств является
следствием образования неметаллами
двух типов кристаллических
решеток:
МОЛЕКУЛЯРНОЙ
АТОМНОЙ
Р
Р
Р
Кристалл белого фосфора (Р4 )
●
Кристаллы алмаза
( С )Р
Слайд 16 Аллотро́пия (от др-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и того
же химического элемента в виде двух и более простых веществ, различных по
строению и свойствам: так называемых аллотропических модификаций или аллотропических форм.словарь
Слайд 17
Причины аллотропии:
Разные типы кристаллических решеток (белый фосфор Р4
– молекулярная, красный фосфор Р – атомная).
Разная структура
кристаллической решетки (алмаз – тетраэдрическая, графит – слоистая).
Разный состав молекул аллотропных модификаций (О2 и О3).
Слайд 18 Элементарный фосфор в обычных условиях представляет собой несколько
устойчивых аллотропных модификаций; вопрос аллотропии фосфора сложен и до
конца не решён. Обычно выделяют четыре модификации простого вещества — белый, красный, чёрный и металлический фосфор.
Слайд 19
Ромбическая (a - сера) - S8
t°пл. = 113°C;
ρ = 2,07 г/см3. Наиболее устойчивая модификация.
Моноклинная (b -
сера) - S8темно-желтые иглы, t°пл. = 119°C; ρ = 1,96 г/см3. Устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую.
Пластическая Sn
коричневая резиноподобная (аморфная) масса. Неустойчива, при затвердевании превращается в ромбическую.





























