Слайд 2
Неметаллы – химические элементы, которые образуют в свободном
виде простые вещества, не обладающие физическими свойствами металлов.
К неметаллам
относятся инертные газы.
Каждая молекула инертного газа состоит
из одного атома.
Слайд 4
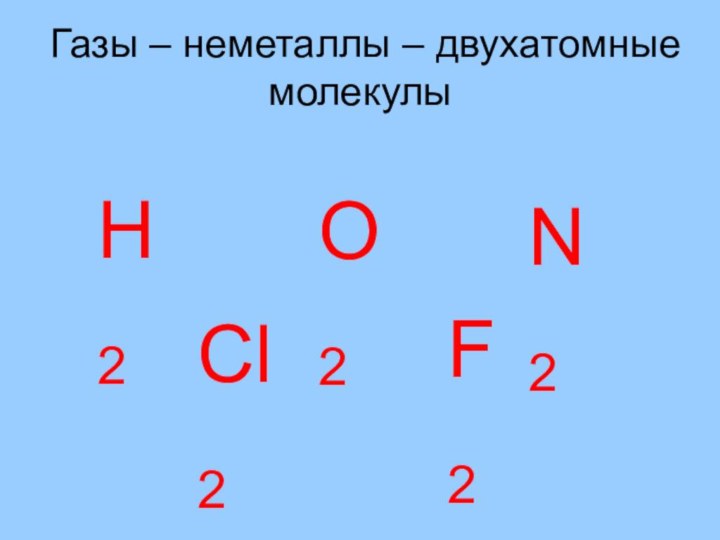
Газы – неметаллы – двухатомные молекулы
Н2
О2
N2
Cl2
F2
Слайд 6
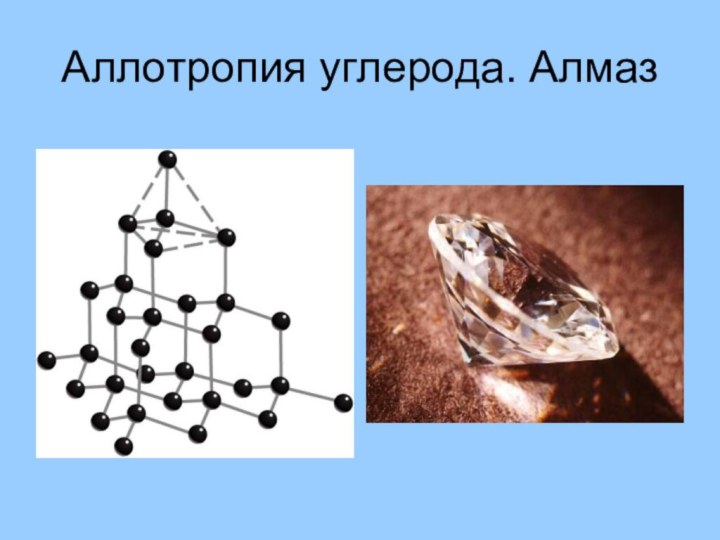
Способность атомов одного химического элемента образовывать несколько простых
веществ называют аллотропией, а эти простые вещества – аллотропными
видоизменениями или модификациями
Слайд 7
Жидкие вещества - неметаллы
В начало
Слайд 8
У некоторых неметаллов наблюдается проявление аллотропии. Так, для
газообразного кислорода характерны две аллотропных модификации — кислород (O2) и
озон (O3), у твёрдого углерода множество форм — алмаз, астралены, графен, графан, графит, карбин, лонсдейлит, фуллерены, стеклоуглерод, диуглерод, углеродные наноструктуры (нанопена, наноконусы, нанотрубки, нановолокна) и аморфный углерод уже открыты, а ещё возможны и другие модификации, например, чаоит и металлический углерод.
В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод.
Слайд 9
Твёрдое вещество – неметалл - йод
Далее
Слайд 10
Характерной особенностью неметаллов является большее (по сравнению с

металлами) число электронов на внешнем энергетическом уровне их атомов.
Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
Благодаря высоким значениям эн
ергии ионизации неметаллов, их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и амфотерных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
В свободном виде могут быть газообразные неметаллические простые вещества — фтор, хлор, кислород, азот, водород, инертные газы, твёрдые — иод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор, при комнатной температуре в жидком состоянии существует бром.
Слайд 13
Аллотропия фосфора. Красный и белый фосфор
Р4
Слайд 14
Аллотропия серы. Кристаллическая, пластическая и моноклинная