- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Основные законы химии
Содержание
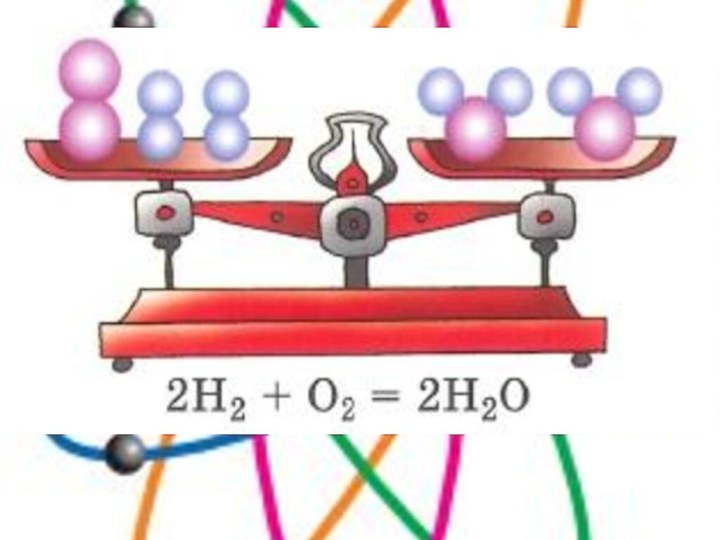
- 2. Закон сохранения массы веществаМихаил Васильевич Ломоносовв 1748
- 4. Задание Расставьте коэффициенты в химических уравнениях:
- 5. Закон постоянства состава веществ.Жозеф Луи Пруст(1754 –
- 9. ЗаданиеВ каких массовых отношениях соединяются химические элементы
- 10. МольМоль – это количество вещества (n), масса
- 11. Определение количества вещества по его массеm-=Mnn -
- 13. ЗаданиеОпределите количество вещества железа в оксиде железа
- 14. Закон Авогадро.Амедео Авогадро (1776 – 1856)В равных
- 15. следовательно:При нормальных условиях 1 моль различных газов
- 16. Vm - молярный объем газа (постоянная Авогадро,
- 19. Скачать презентацию
- 20. Похожие презентации


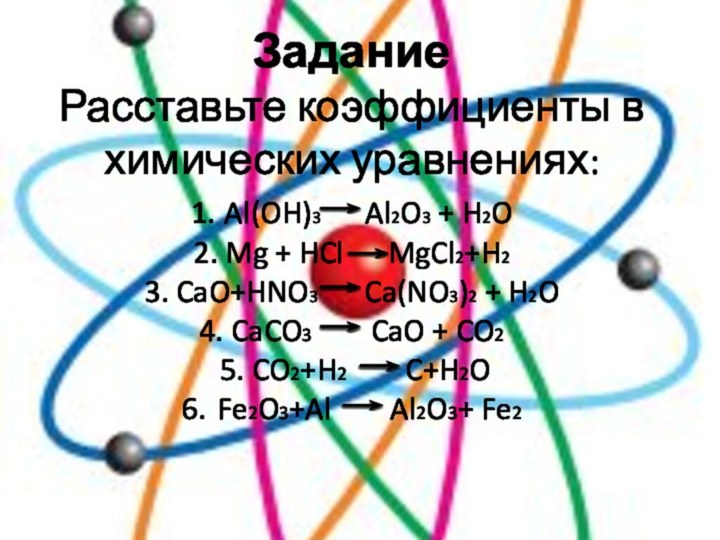











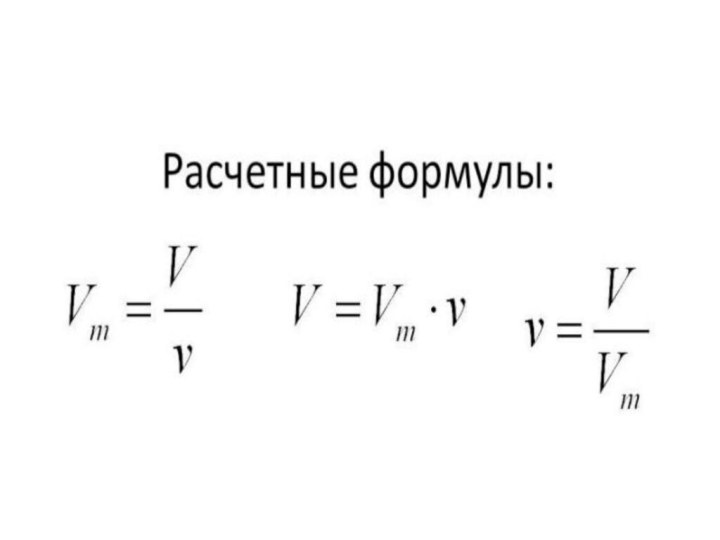

Слайд 4 Задание Расставьте коэффициенты в химических уравнениях: 1. Al(OH)3
Al2O3 + H2O 2. Mg + HCl MgCl2+H2 3.
CaO+HNO3 Ca(NO3)2 + H2O 4. CaCO3 CaO + CO2 5. CO2+H2 C+H2O 6. Fe2O3+Al Al2O3+ Fe2
Слайд 5
Закон постоянства состава веществ.
Жозеф Луи Пруст
(1754 – 1826)
Закон
был открыт французским ученым в 1808 году для вещества
молекулярного строения.Каждое чистое вещество не зависимо от способа его получения всегда имеет постоянный качественный и количественный состав
формулировка закона:
Слайд 9
Задание
В каких массовых отношениях соединяются химические элементы в
серной кислоте?
Водород соединяется с серой в массовых отношениях 1:16.
используя данные об относительных атомных массах этих элементов выведите химическую формулу сероводорода?
Слайд 10
Моль
Моль – это количество вещества (n), масса которого,
выраженное в граммах, численно равная молекулярной массе, в котором
содержится 6•10 23 молекул(или других структурных частиц) этого вещества
Моль – это количество вещества, содержащее столько структурных единиц (молекул, атомов, ионов и тд.) сколько содержится в 1,012 кг изотопа 12 С
Например,
1 моль воды имеет массу, равную 18 грамм, так как Мr(Н2О)= 18 и содержит 6•10 23 молекул
Тогда:
1 моль кислорода (O2) имеет массу – 32 г. и содержит 6•10 23 молекул ,
1 моль алюминия - ….,
2 моль аммиака (NH3) - ….. .
Слайд 11
Определение количества вещества по его массе
m
-
=
M
n
n - количество
вещества (моль),
m – масса вещества (грамм),
M – молярная масса
вещества (г/моль)
Слайд 13
Задание
Определите количество вещества железа в оксиде железа (III)
массой 56г?
Вычислите какое количество вещества карбоната кальция заключается в
40 г CaCO3?
Слайд 14
Закон Авогадро.
Амедео Авогадро
(1776 – 1856)
В равных объемах
различных газов при одинаковых условиях (температура, давление) содержится одинаковое
число молекул.1 моль газа при T° = 273 К, p = 101325 Па занимает объём
V = 22,4 литра.
В одном моле различных веществ содержится
NA = 6,022 х 10²³ молекул ( число Авогадро)
Слайд 15
следовательно:
При нормальных условиях 1 моль различных газов занимает
объем, равный 22,4 л. Этот объем называется молярным объемом
газа.22,4 литра – постоянная (число) Авогадро (при н.у.)