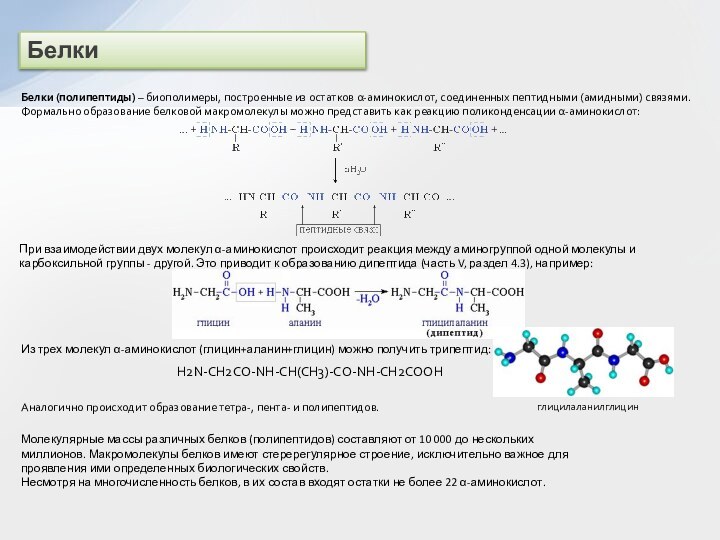
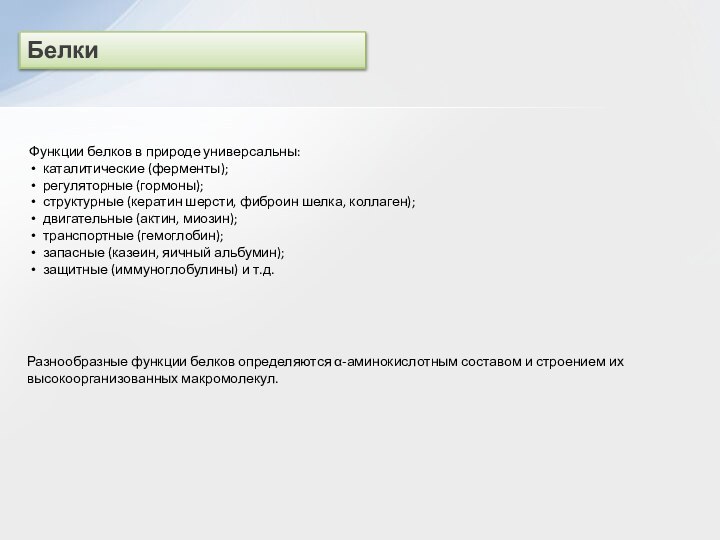
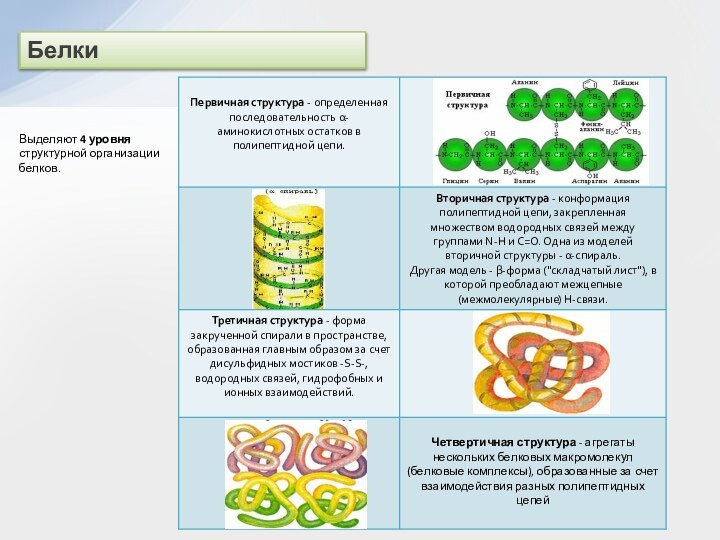
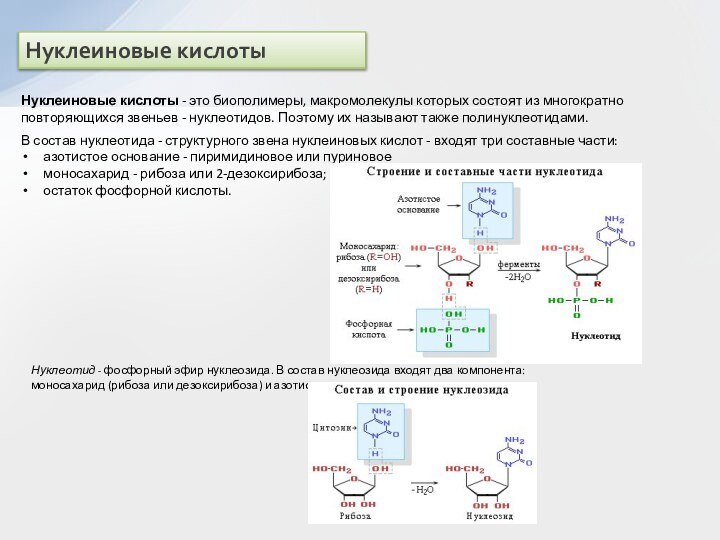
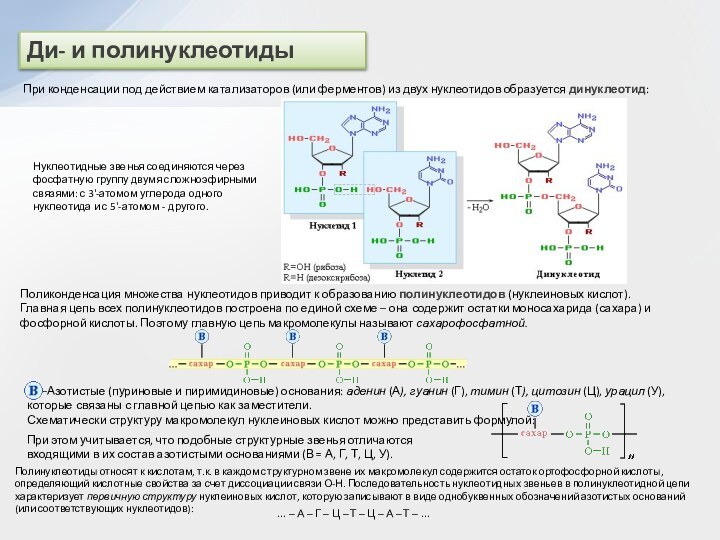
и вторичные амины образуют межмолекулярные водородные связи (несколько более
слабые, чем Н-связи с участием группы О–Н).
Это объясняет относительно высокую температуру кипения аминов по сравнению с неполярными соединениями со сходной молекулярной массой. Например:
Третичные амины не образуют ассоциирующих водородных связей (отсутствует группа N–H). Поэтому их температуры кипения ниже, чем у изомерных первичных и вторичных аминов (триэтиламин кипит при 89 °С, ан-гексиламин – при 133 °С).
По сравнению со спиртами алифатические амины имеют более низкие температуры кипения (т. кип. метиламина -6 °С, т. кип. метанола +64,5 °С). Это свидетельствует о том, что амины ассоциированы в меньшей степени, чем спирты, поскольку прочность водородных связей с атомом азота меньше, чем с участием более электроотрицательного кислорода.
При обычной температуре только низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха. Ароматические амины – бесцветные высококипящие жидкости или твердые вещества.
Амины способны к образованию водородных связей с водой:
Поэтому низшие амины хорошо растворимы в воде. С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается, т.к. увеличиваются пространственные препятствия образованию водородных связей. Ароматические амины в воде практически не растворяются.






![Химия. Азотсодержащие соединения Получение аминов3. Восстановление нитрилов с образованием первичных аминов:R-C N + 4[H]](/img/tmb/13/1275670/e52b9f6a65b53af0843fcb3d604a4a8a-720x.jpg)