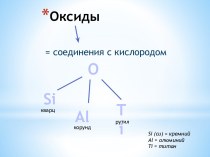
Слайд 2
Химические реакции
Химические элементы, из которых состоит живая и
неживая природа, находятся в постоянном движении, потому что непрерывно
изменяются вещества, которые состоят из этих элементов.
Химические реакции (от лат. Ре акция – противодействие, отпор) – это ответное действие веществ на воздействие других веществ и физических факторов (температуры, давления, излучения и др.)
Однако такому определению соответствует также и физические изменения, происходящие с веществами, - кипение, плавление, конденсация и др.
Слайд 3
Химические реакции
Поэтому необходимо уточнить, что химические реакции –
это процессы, в результате которых разрушаются старые химические связи
и возникают новые и, как следствие, - из исходных веществ образуются новые вещества.
Химические реакции непрерывно происходят как внутри нашего организма, так и в окружающем нас мире. Бесчисленное множество реакций принято классифицировать по различным признакам.
Слайд 4
Химические реакции, или химические явления – это
процесс, в результате которого из одних веществ образуются другие
вещества, отличающиеся от исходных по составу, или строению, а следовательно и по свойствам.
Слайд 5
Классификация химических реакций
Слайд 6
Реакции соединения – это реакции, в результате которых
из двух и более веществ образуется одно сложное вещество.
S+O2=SO2
Реакции
разложения – это реакции, в результате которых их одного сложного вещества образуется несколько новых веществ.
2HgO = 2Hg+O2
Реакции замещения – это реакции, в результате которых атомы простого вещества замещают атомы одного из элементов в сложном веществе.
2Na+ 2H2O=2NaOH+2H
Реакции обмена – это реакции, в которых два сложных вещества обмениваются своими составными частями.
Na2CO3+2HCL=2NaCL+CO2+H2O
Реакция нейтрализации -это реакция взаимодействия кислоты и щелочи.
Слайд 7
Классификация химических реакций
Слайд 8
Эндотермические реакции - это реакции, протекающие с поглощением
теплоты.
CaCO3=CaO+CO2-Q
Экзотермические реакции- это реакции, протекающие с выделением теплоты (горение).
2Mg+O2=2MgO+Q
Тепловой
эффект химической реакции – это количество теплоты, которое выделяется или поглощается в результате химической реакции.
Слайд 9
Классификация химических реакций
Слайд 10
Обратимые реакции – это химические реакции, которые протекают
одновременно в двух противоположных направления – прямом и обратном.
Необратимые
реакции – это химические реакции, в результате которых исходные вещества практически полностью превращаются в конечные продукты.
Слайд 11
Классификация химических реакций
Слайд 12
Гомогенные реакции – это реакции, которые протекают в
однородной среде (нет поверхности раздела между реагирующими веществами) например,
в смеси газов, или растворов (от греч. «гомо» – равный, одинаковый).
Гетерогенные реакции – это реакции, которые протекают между веществами в неоднородной среде(есть поверхность раздела между реагирующими веществами) например, на поверхности соприкосновения твердого веществаи жидкости, газа и жидкости, твердого вещества и газа и т.д. (от греч. «гетеро» – разный, другой).
Слайд 13
Классификация химических реакций
Слайд 14
Каталитические реакции- это реакции, идущие с участием катализатора.
Ферментативные
реакции – это реакции, идущие с участием белковых катализаторов
(ферментов).
Некаталитические реакции – это реакции, идущие без участия катализатора.
Слайд 15
Классификация химических реакций
Слайд 16
Окислительно – восстановительными реакциями называют реакции, протекающие с
изменением степеней окисления элементов, образующих вещества, участвующие в реакции.
Это
все реакции замещения, соединения, разложения, в которых участвует хотя бы одно простое вещество.
Элементы, или вещества, принимающие электроны, называются окислителями. В ходе реакции они восстанавливаются.
Элементы, или вещества, отдающие электроны, называются восстановителями. В ходе реакции они окисляются.
Слайд 17
Лабораторный опыт №3 «Замещение железом меди в растворе
сульфата меди (II)»