- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Классификация солей
Содержание
- 2. Что такое соли?В быту мы привыкли иметь
- 3. — это электролиты, при диссоциации которых образуются
- 4. Формула соли строится с учетом валентностей металла
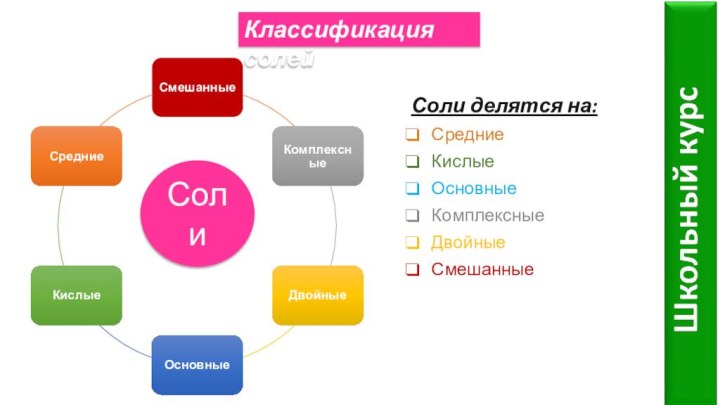
- 5. СолиКлассификация солейСоли делятся на:СредниеКислыеОсновныеКомплексныеДвойныеСмешанные
- 6. Средние соли
- 7. Кислые соли
- 8. Кислые соли чаще всего образуются в избытке
- 9. Основные солиCrOHSO4(Cr(OH)2)3PO4(CrOH)3(PO4)2Cr(OH)2ClCrOHCl2(Cr(OH)2)2SO4
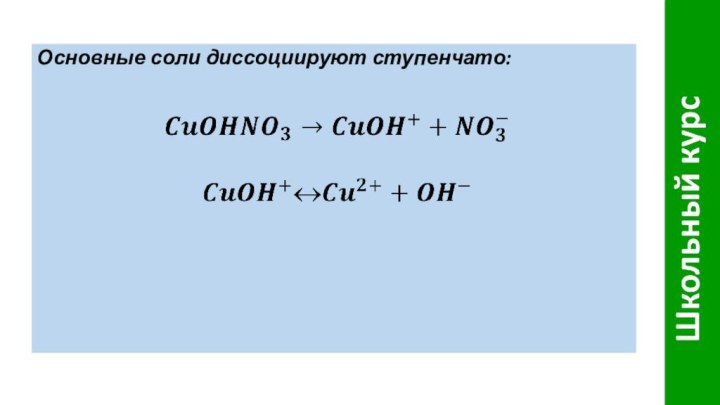
- 10. Основные соли диссоциируют ступенчато:
- 11. Основные соли образуются в избытке основания: 2Cu(OH)2 + H2SO4 → (CuOH)2SO4 + 2H2O основная сольCu(OH)2 + H2SO4 → CuSO4 + 2H2O средняя соль
- 12. Комплексные
- 13. Двойные соли
- 14. Смешанные соли
- 15. Химические свойства 1. Растворы солей взаимодействуют с металлами,
- 17. 7. Некоторые соли взаимодействуют с водой с
- 18. Лабораторная работа №4Химические свойства солей и способы
- 19. Ход работы: Опыт № 1. Взаимодействие металла
- 20. Опыт № 2. Взаимодействие металла с кислотой
- 21. Опыт № 3. Взаимодействие металла с раствором
- 22. Опыт № 5. Взаимодействие соли с кислотой
- 23. Опыт № 8. Образование кислой соли Налить в пробирку
- 24. Скачать презентацию
- 25. Похожие презентации
Что такое соли?В быту мы привыкли иметь лишь с одной солью − поваренной, т.е. хлоридом натрия NaCl. Однако в химии солями называют целый класс соединений.




















Слайд 3
— это электролиты, при диссоциации которых образуются катионы
металлов (или ион аммония) и анионы кислотных остатков.
Соли
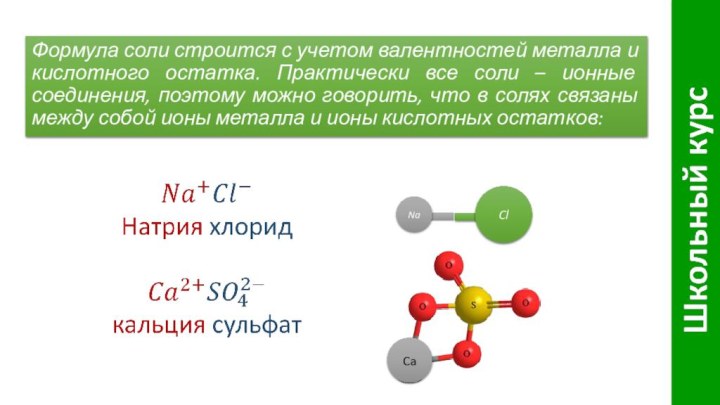
Слайд 4 Формула соли строится с учетом валентностей металла и
кислотного остатка. Практически все соли – ионные соединения, поэтому
можно говорить, что в солях связаны между собой ионы металла и ионы кислотных остатков:Na
Cl
Ca
Слайд 8
Кислые соли чаще всего образуются в избытке кислоты:
Mg(OH)2 +
2H2SO4 → Mg(HSO4)2 + 2H2O
кислая соль
Mg(OH)2 + H2SO4 → MgSO4 + 2H2O
средняя соль
Слайд 11
Основные соли образуются в избытке основания:
2Cu(OH)2 + H2SO4 → (CuOH)2SO4 +
2H2O
основная соль
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
средняя соль
Слайд 15
Химические свойства
1. Растворы солей взаимодействуют с металлами, расположенными
в ряду напряжений левее, чем металл, входящий в состав
соли:Zn + FeSO4 → ZnSO4 + Fe
2.Растворимые в воде соли взаимодействуют с основаниями:
CuSO4 + 2NaOH → Cu(OH)2 ↓ + Na2SO4,
KHSO4 + KOH → K2SO4 + H2O.
3. Соли взаимодействуют с растворами кислот:
CaCI2 + H2SO4 → CaSO4 ↓ + 2HCI,
Ca(HCO3)2 + 2HCI → CaCI2 + H2O + CO2 ↑
MgOHCI + HCI → MgCI2 + H2O.
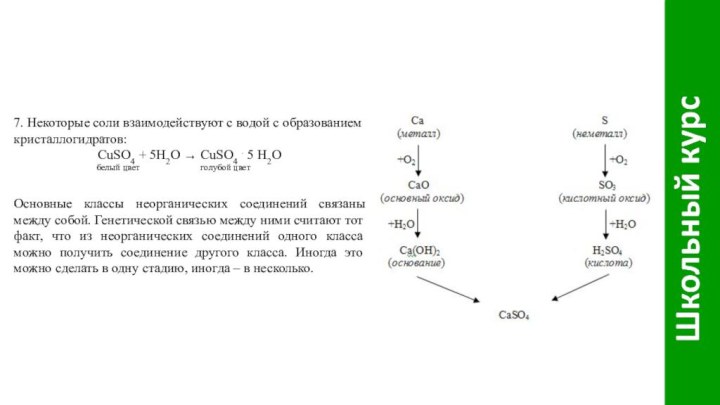
Слайд 17 7. Некоторые соли взаимодействуют с водой с образованием
кристаллогидратов:
CuSO4 + 5H2O ® CuSO4 . 5 Н2О
белый цвет голубой цветОсновные классы неорганических соединений связаны между собой. Генетической связью между ними считают тот факт, что из неорганических соединений одного класса можно получить соединение другого класса. Иногда это можно сделать в одну стадию, иногда – в несколько.
Слайд 18
Лабораторная работа №4
Химические свойства солей и способы их
получения
Цель работы:
ознакомиться с химическими свойствами солей и способами
их получения. Освоить работу с аппаратом Киппа.Посуда и реактивы:
аппарат Киппа, пробирки, микрошпатель, спиртовка, фильтровальная бумага, фарфоровая чашка. Растворы сульфата меди, серной кислоты, иодида калия, нитрата серебра, хлорида никеля, кобальта, бария, щелочи, гидроксида кальция, порошок серы, железные опилки, кусочки цинка.
Слайд 19
Ход работы:
Опыт № 1. Взаимодействие металла с
неметаллом
В пробирку поместить один микрошпатель железных опилок и
один микрошпатель порошка серы. Тщательно перемешать и подогреть на спиртовке, зажав пробирку в держателе. Убедитесь, что реакция сопровождается выделением большого количества тепла, соблюдая правила техники безопасности. Пробирку охладить и содержимое ее перенести на лист фильтровальной бумаги. Полученное вещество однородно и имеет черный цвет. Написать уравнение реакции и назвать полученную соль.
Слайд 20
Опыт № 2. Взаимодействие металла с кислотой
В
пробирку налить 2–3 см разбавленной серной кислоты и бросить
кусочек цинка. Наблюдается бурная реакция с выделением пузырьков газа (водорода) и образованием соли, в чем можно убедиться, выпарив несколько капель содержимого пробирки в фарфоровой чашке. Написать уравнение реакции. Уравнять методом электронного баланса.
Слайд 21
Опыт № 3. Взаимодействие металла с раствором соли
В голубой раствор сульфата меди (II) опустить 2–3 кусочка
гранулированного цинка, нагреть жидкость до кипения и перемешивать ее до обесцвечивания. Наблюдать выделение красного металла. Написать уравнение реакции, сделать выводы. Опыт № 4. Взаимодействие неметалла с раствором соли
Внести в пробирку 3–4 см3 раствора иодида калия и прилить несколько капель хлорной воды. Выпадает черный осадок мелкодисперсного иода. Написать уравнение реакции и указать, какая соль образовалась.
Слайд 22
Опыт № 5. Взаимодействие соли с кислотой
Смешать
в пробирке немного раствора нитрата серебра с разбавленной соляной
кислотой. Наблюдается выделение белого творожистого осадка. Эта реакция является качественной на катион серебра Ag+ и анион СI - .Написать уравнения реакций.Опыт № 6. Взаимодействие соли с основанием
В две пробирки налить небольшое количество хлоридов никеля (II) и кобальта (II). Добавить в обе пробирки 5–6 капель раствора гидроксида натрия. Отметить цвет выпавших осадков и указать, какие соли при этом образовались. Написать уравнения реакций.
Опыт № 7. Взаимодействие солей между собой
К раствору хлорида бария в пробирке прилить раствор сульфата калия.
К раствору нитрата бария прилить раствор сульфата магния.
В обоих случаях наблюдается выпадение белого осадка. Эта реакция является качественной на катион Ba2+ и анион SO42-. Какая соль выпадает в осадок и какие соли образуются в растворе в первом и во втором случае?
Слайд 23
Опыт № 8. Образование кислой соли
Налить в пробирку 3–4
см3 известкового молока Ca(OH)2 и пропустить в раствор оксид углерода (IV) из
аппарата Киппа. Наблюдать выпадение осадка средней соли, затем продолжить пропускать углекислый газ до растворения осадка. Растворение осадка объясняется образованием кислой соли (растворимость ее больше, чем средней) Ca(HCO3)2. Написать уравнения реакций.Опыт № 9. Образование основной соли
В две пробирки внести по 6–8 капель разбавленного раствора сульфата меди (II). В одну пробирку быстро добавить избыток раствора щелочи. Наблюдать образование ярко-голубого осадка гидроксида меди (II).
В другую пробирку разбавленный раствор щелочи прибавлять по каплям. В этом случае образуется светло-голубой осадок основной соли (CuOH)2SO4. Написать уравнение реакций и назвать образовавшиеся соли в обеих пробирках.