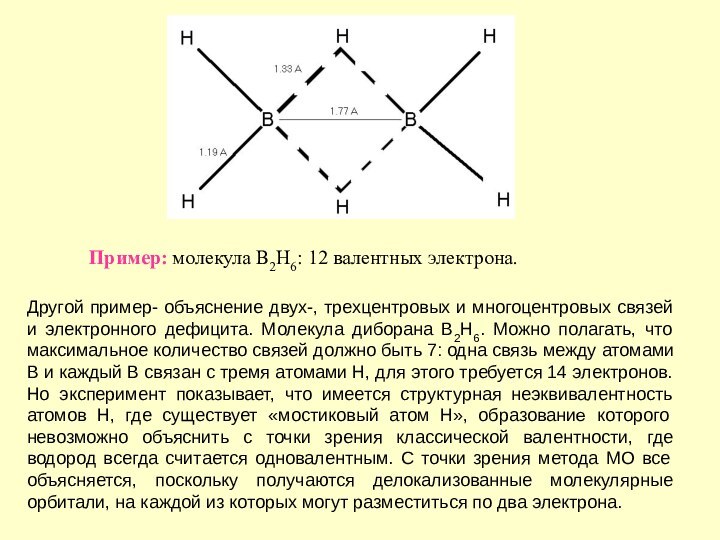
части точной Ψ(r,R) волновой функции нельзя. Это можно сделать
только приближенно, если ввести электронную волновую функцию ΨЭ и сделать ее параметрически зависимой от расположения (R) ядер – это есть приближение Борна- Оппенгеймера.
Для этого фиксируется ядерная конфигурация (R) в предположении, что движение ядер происходит гораздо медленнее, чем движение электронов. В этом случае, молекулярная волновая функция Ψ(r,R) может быть записана как произведение электронной ΨЭ({r,R}) и ядерной ΨЯ({R}) компонент:
Ψ({r,R}) = ΨЭ({r,R}) ΨЯ({R}),
Обоснованность приближения Борна-Оппенгеймера: отношение масс электрона и ядра не больше, чем 1/1836, как это имеет место в случае самого легкого атома водорода.