- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии в 8 классе Типы химической связи
Содержание
- 2. Домашнее задание:§7,8,9 Ответить на вопросы в конце параграфовПисьменно:№4 с.50 (§7)№ 1,2,3,4 с.60 (§9)
- 4. +
- 7. Проверочная работа
- 8. Ряд чисел 2,8,5 соответствует распределению электронов в атоме элемента:1)азота 2)фтора 3)фосфора 4)хлора
- 9. 2. Ряд чисел, соответствующий распределению электронов по
- 10. 3. Сокращённая электронная формула 2S22P5 соответствует атомам :1)фтора 2)хлора 3)азота 4)фосфора
- 11. 4. 2S22Р3 .Укажите знак химического элемента.1) Р 2) N 3) As 4) В
- 12. 5. Химический элемент электронная формула которого 1S22S22P63S23P4 1)C 2)О 3)Si 4)S
- 13. 6. Количество валентных электронов у атома элемента
- 14. 7. Заряд ядра атома кальция:1)+2 2)+20 3)+40 4)+4
- 15. 8. Количество нейтронов в атоме железа-56:1)30 2)26 3)56 4)55
- 16. 9. Количество энергетических уровней в атоме элемента хлор:1)35 2)17 3)7 4)3
- 17. 10. У элементов азот и фосфор одинаковое количество:1)электронов 2)валентных электронов 3)протонов 4)энергетических уровней
- 18. 11. У элементов алюминий и фосфор одинаковое количество:1)электронов 2)валентных электронов 3)протонов 4)энергетических уровней
- 19. 12. В каком ряду количество радиус атома
- 20. Ответы
- 21. 3 3 1 2 4 2 2 1 4 2 4 3
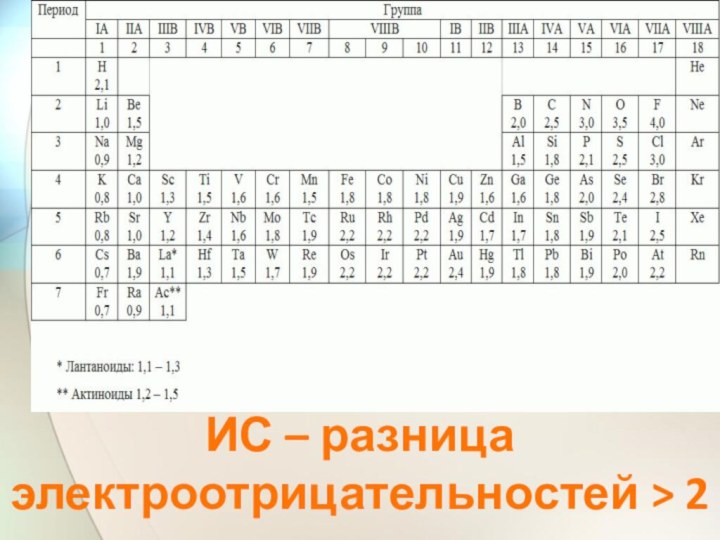
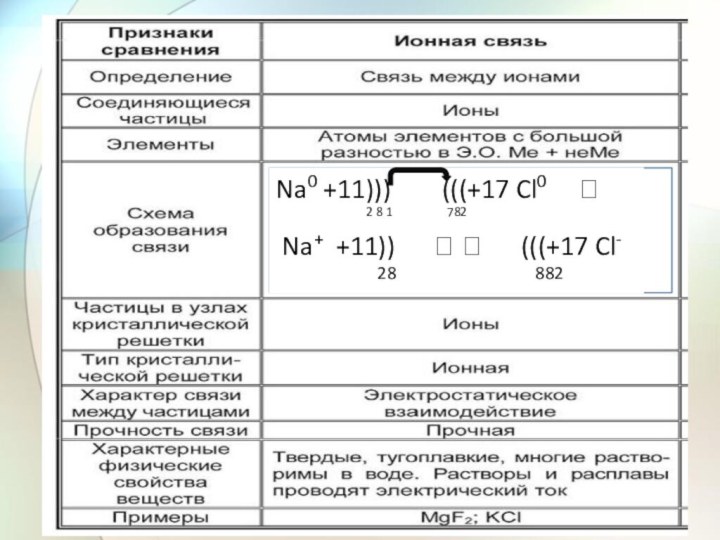
- 25. ИС – разница электроотрицательностей > 2
- 26. Na0 +11))) (((+17 Cl0
- 27. Na + Cl:.::**.:::переход ēэо Na0
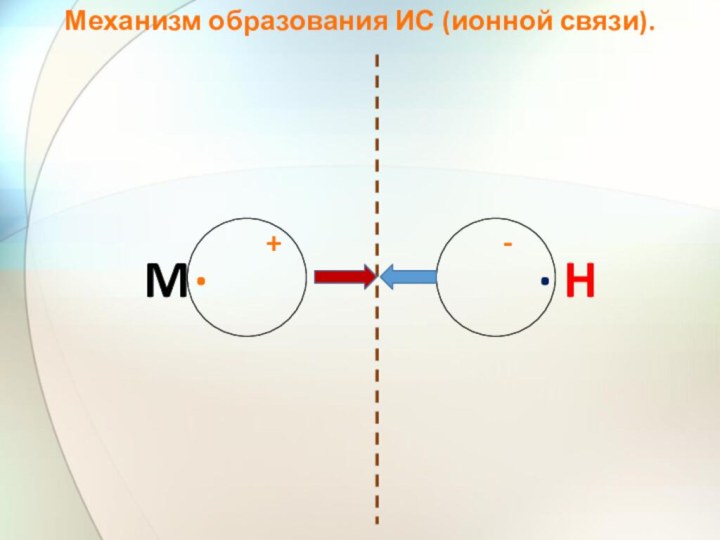
- 28. Механизм образования ИС (ионной связи).M · H · +-
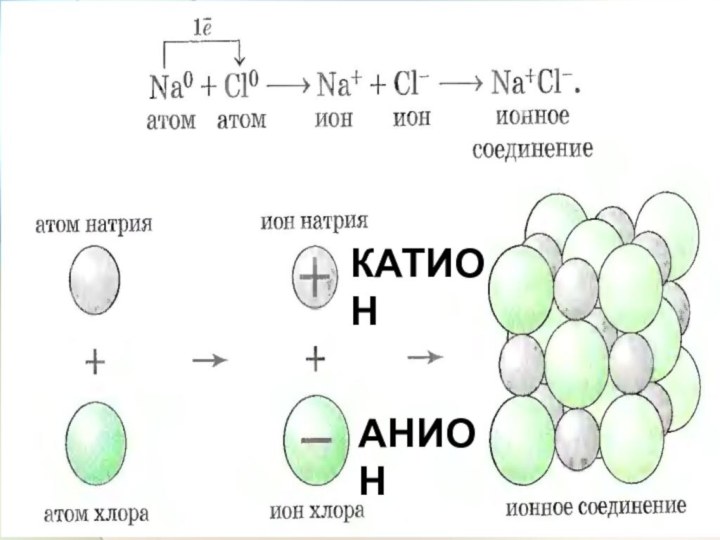
- 29. КАТИОНАНИОН
- 30. Термины:ЭлектроотрицательностьИоныКатионАнионИонная связь
- 31. Cl2, NaCl, H2O, N2, SO3,
- 32. NaCl, BaO, K2O, LiF, AlBr3Выпишите вещества с ионной связью
- 33. Ковалентная связь – это химическая связь, возникающая
- 34. Способы перекрывания электронных облаков (образования общих электронных пар).σ-связь (Сигма)π-связь (Пи)
- 35. Механизм образования ковалентных связей.А· + · В A : B
- 36. Механизм образования ковалентных связей.А: + В A : B
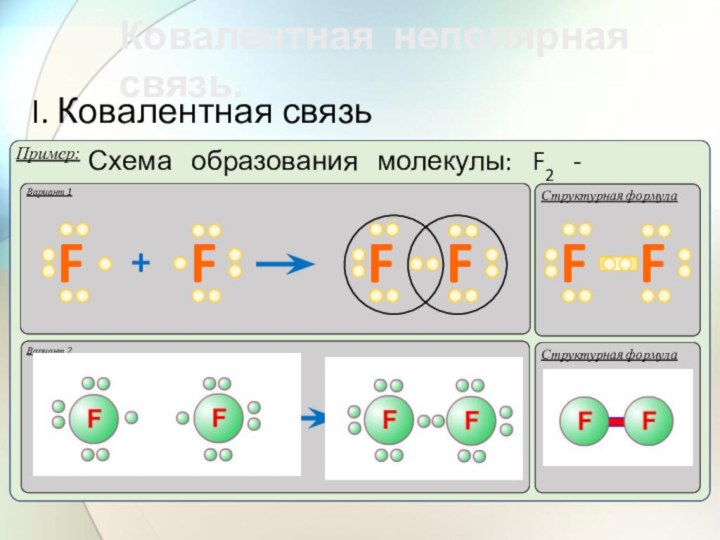
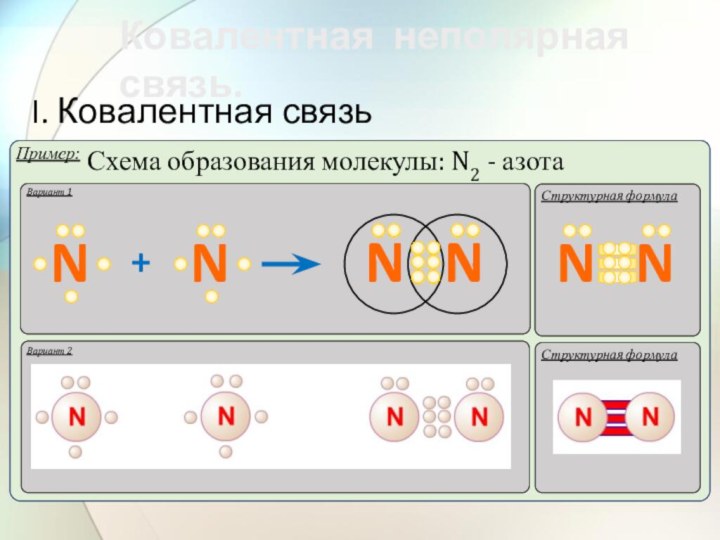
- 37. Ковалентной неполярной связью (КНПС) называется
- 38. Ковалентная неполярная связь. I. Ковалентная связьВариант 1Структурная формулаНН
- 39. Ковалентная неполярная связь. I. Ковалентная связьВариант 1Структурная формула
- 40. Ковалентная неполярная связь. I. Ковалентная связьВариант 1Структурная формула
- 41. Ковалентной полярной связью (КПС) называется
- 42. Механизм образования КПС.А · В ·
- 43. А · В · Сравните механизмы образования КПС и КНПС.А А · · δ+δ-
- 44. F, O, N, Cl, Br, I, S, C, P, As, H, B, SiРяд электроотрицательностей неметалловЭО уменьшается
- 45. Н Сlδ+δ+δ-δ-C H4H2 Oδ-δ+F, O, N,
- 46. А · В · Сравните механизмы образования
- 47. Термины:ЭлектроотрицательностьИоныКатионАнионИонная связьКовалентная связьКНПСКПС
- 48. Закрепление изученного
- 49. Cl2, NaCl, H2O, N2, SO3,
- 52. 1
- 53. 23
- 54. 45
- 55. 678
- 56. 910
- 57. 11
- 58. 12. Найдите соответсвие вещество- химическая связь:
- 59. Ответы
- 61. Скачать презентацию
- 62. Похожие презентации
Домашнее задание:§7,8,9 Ответить на вопросы в конце параграфовПисьменно:№4 с.50 (§7)№ 1,2,3,4 с.60 (§9)





















































Слайд 8 Ряд чисел 2,8,5 соответствует распределению электронов в атоме
элемента:
1)азота
2)фтора
3)фосфора
4)хлора
Слайд 9 2. Ряд чисел, соответствующий распределению электронов по уровням
в атоме хлора:
1) 2,8,5
2) 7,8,2
3)
2,8,7 4)2,8,18,7
Слайд 10
3. Сокращённая электронная формула 2S22P5 соответствует атомам :
1)фтора
2)хлора
3)азота
4)фосфора
Слайд 13 6. Количество валентных электронов у атома элемента с
порядковым номером 16:
1)16
2)6
3)8
4)2
Слайд 17
10. У элементов азот и фосфор одинаковое количество:
1)электронов
2)валентных электронов
3)протонов
4)энергетических уровней
Слайд 18
11. У элементов алюминий и фосфор одинаковое количество:
1)электронов
2)валентных электронов
3)протонов
4)энергетических уровней
Слайд 19
12. В каком ряду количество радиус атома уменьшаются:
1)Al,
Ga, In
2)Al, Mg, Na
3)Na, Mg, Al
4)С,
N, O
Слайд 27
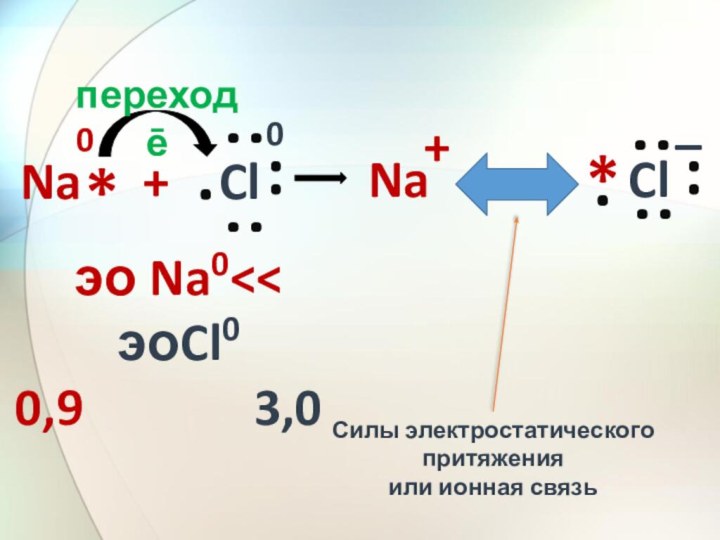
Na + Cl
:
.
:
:
*
*
.
:
:
:
переход ē
эо Na0
эоCl0
0,9 3,0
0
0
Na
+
Cl
_
Силы электростатического
притяженияили ионная связь
Слайд 31
Cl2, NaCl, H2O, N2,
SO3,
S8, HCl, BaO,
P4, P2O5,
NO2, K2O, LiF, H2, AlBr3,Выпишите вещества с ионной связью
Слайд 33 Ковалентная связь – это химическая связь, возникающая за
счёт образования общих электронных пар.
Общая электронная пара – это
область перекрывания электронных облаков
Слайд 34
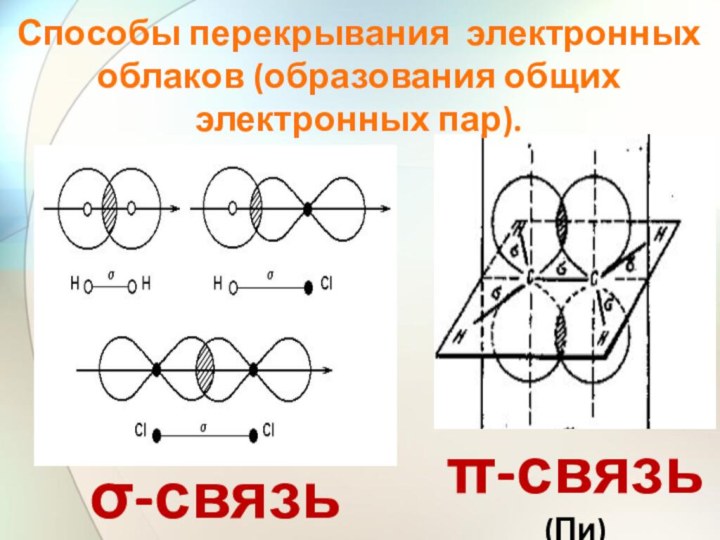
Способы перекрывания электронных облаков (образования общих электронных пар).
σ-связь
(Сигма)
π-связь (Пи)
Слайд 37 Ковалентной неполярной связью (КНПС) называется связь,
которая возникает между одинаковыми элементами-неметаллами, т.е. элементами с одинаковыми
эо.При этом образуется общая электронная пара, которая располагается посередине между атомами неметаллов, т.е. в равной степени принадлежат обоим атомам.
Слайд 41 Ковалентной полярной связью (КПС) называется связь,
которая возникает между разными элементами-неметаллами, т.е. элементами с отличающимися
ЭО.При этом образуется общая электронная пара, которая смещается к атому с большей ЭО. Атомы приобретают частичные заряды: δ+ или δ- (дельта плюс, дельта минус).