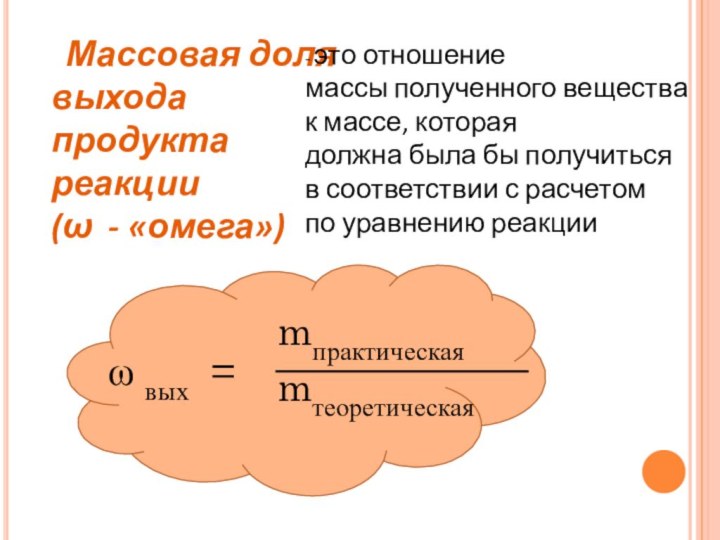
это отношение массы полученного вещества к массе, которая должна
была бы получиться в соответствии с расчетом по уравнению реакцииω вых =
mпрактическая
mтеоретическая
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть

















ω вых =
mпрактическая
mтеоретическая
ПОЧЕМУ?
… в реальных химических реакциях масса продукта всегда оказывается меньше расчетной …а? Не знаете?
2. Даны массы исходного вещества и выход продукта реакции.
Определить массу продукта.
3. Даны массы продукта и выход продукта.
Определить массу исходного вещества.
Алгоритм решения задач первого типа
(найдите «выход продукта реакции»)
Дано: Решение:
m(ZnO) = 32,4 г
mпр(Zn) = 24 г
Найти:
ωвых(Zn) - ?
1. Внимательно прочитай условие задачи
2. Составьте «Дано» и «Найти»
n (Zn) = n (ZnO) = = = 0,4 моль
m (ZnO)
M (ZnO)
32, 4 г
81 г/моль
4. Вычисли массу теоретическую продукта реакции
5. Вычисли массовую долю продукта реакции по известной формуле
n (Zn) = n (ZnO) = = = 0,4 моль
m (ZnO)
M (ZnO)
32, 4 г
81 г/моль
ωвых = = = 0, 92 (92%)
mпр( Zn)
mтеор (Zn)
24 г
26 г
Ответ: 92%
Алгоритм решения задач второго типа
(найдите «массу продукта реакции»)
(практическую)
Дано: Решение:
m (Al(OH)3)= 23,4 г
ω вых (Al2O3) = 92%
Найти:
m пр (Al2O3) - ?
1. Внимательно прочитай условие задачи
2. Составьте «Дано» и «Найти»
2Al(OH)3 = Al2O3 +3H2O
Решение:
2Al(OH)3 = Al2O3 +3H2O
23,4 г
?
2 моль
1 моль
По уравнению:
n(Al2O3) = ½ n(Al(OH)3= ½ =
m (Al(OH)3)
M (Al(OH)3)
23,4 г
78 г /моль
= 0,15 моль
mтеор. (Al2O3) = n M = 0,15 моль 102 г/моль = 15,3 г
Решение:
2Al(OH)3 = Al2O3 +3H2O
23,4 г
?
2 моль
1 моль
По уравнению:
n(Al2O3) = ½ n(Al(OH)3= ½ =
m (Al(OH)3)
M (Al(OH)3)
23,4 г
78 г /моль
= 0,15 моль
mтеор. (Al2O3) = n M = 0,15 моль 102 г/моль = 15,3 г
m пр.(Al2O3) = 15,3 г 0,92 = 14 г
Ответ: 14 грамм
2. Составьте «Дано» и «Найти»
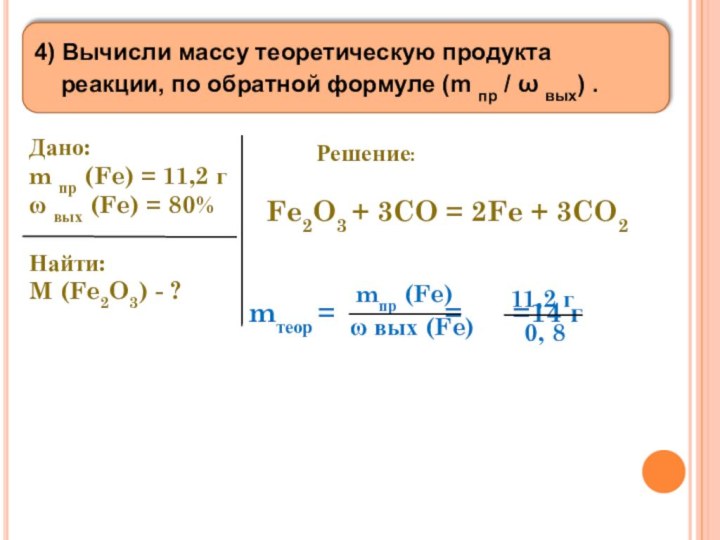
Дано:
m пр (Fe) = 11,2 г
ω вых (Fe) = 80%
Найти:
M (Fe2O3) - ?
Решение:
Решение:
Fe2O3 + 3CO = 2Fe + 3CO2
Решение:
Fe2O3 + 3CO = 2Fe + 3CO2
mтеор = = =14 г
mпр (Fe)
ω вых (Fe)
11,2 г
0, 8