- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Бескислородные соединения галогенов
Содержание
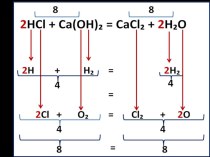
- 2. Бескислородные соединения галогеновкислота хлористоводородная (хлороводородная);натрия хлорид;калия хлорид;натрия бромид;калия бромид;натрия йодид;калия йодид
- 3. Кислота хлористоводороднаяПолучение1. Растворение в воде хлороводорода;2. Прямой
- 4. Свойства лекарственных препаратов кислоты хлористоводороднойВ водных растворах
- 5. Идентификация1. С помощью нитрата серебраБелый творожистый осадокОсадок
- 6. ПрименениеПри недостаточной кислотности желудочного сока
- 7. Соединения хлоридов, бромидов, йодидовСвойства
- 8. Катион натрия обнаруживают:1. По окрашиванию бесцветного пламени
- 9. 3. В уксуснокислой среде с гексанитрокобальтатом (III)
- 10. 2. Реакции окисления с последующим извлечением хлороформомХлороформный
- 11. Количественное определениеАргентометрияХлориды и бромиды титруют в нейтральной
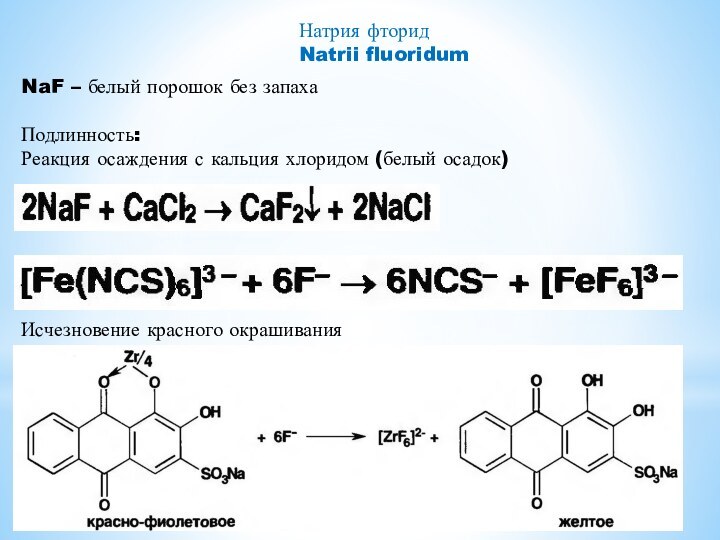
- 12. Натрия фторидNatrii fluoridumNaF – белый порошок без
- 13. Скачать презентацию
- 14. Похожие презентации











Слайд 2
Бескислородные соединения галогенов
кислота хлористоводородная
(хлороводородная);
натрия хлорид;
калия хлорид;
натрия бромид;
калия
бромид;
Слайд 3
Кислота хлористоводородная
Получение
1. Растворение в воде хлороводорода;
2. Прямой синтез
из водорода и хлора, которые предварительно получают при электролизе
раствора хлорида натрияВодород и хлор взаимодействуют в контактных печах при высокой температуре
Слайд 4
Свойства лекарственных препаратов кислоты хлористоводородной
В водных растворах хлороводород
полностью диссоциирует с образованием хлорид-иона и гидратированного протона (оксоний-иона)
Слайд 5
Идентификация
1. С помощью нитрата серебра
Белый творожистый осадок
Осадок не
растворим в воде и в растворе азотной кислоты, но
растворим в растворе аммиака2. При нагревании с диоксидом марганца
Характерный запах
Количественное определение
Кислотно-основное титрование (КОТ) – нейтрализация
Титрант – гидроксид натрия, индикатор – метиловый-оранжевый
2. Аргентометрия по хлорид-иону
Слайд 8
Катион натрия обнаруживают:
1. По окрашиванию бесцветного пламени горелки
в желтый цвет;
2. По образованию зеленовато-желтого кристаллического осадка с
цинкуранилацетатом (октацетат-триуранилатом цинка) в уксуснокислой среде: Катион калия обнаруживают:
1. По окрашиванию бесцветного пламени горелки в фиолетовый цвет (при рассмотрении через синее стекло – пурпурно-красный)
2. По реакции с винной кислотой (в нейтральной или уксуснокислой среде) по образованию белого кристаллического осадка
Слайд 9 3. В уксуснокислой среде с гексанитрокобальтатом (III) натрия
желтый кристаллический осадок
Галогенид-ионы
1. С раствором нитрата серебра в азотнокислой
средеСвойства галогенидов серебра
Слайд 10
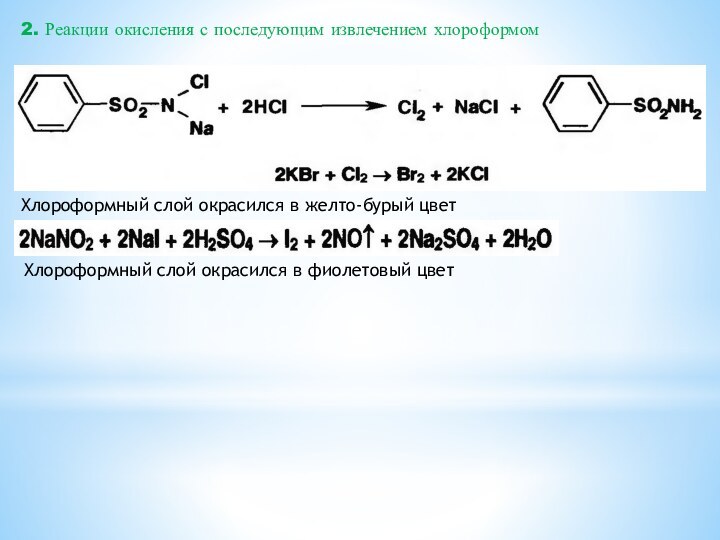
2. Реакции окисления с последующим извлечением хлороформом
Хлороформный слой
окрасился в желто-бурый цвет
Хлороформный слой окрасился в фиолетовый цвет
Слайд 11
Количественное определение
Аргентометрия
Хлориды и бромиды титруют в нейтральной среде,
индикатор – хромат калия (метод Мора). Конечная точка титрования
– осадок оранжево-красного цвета.2. Йодиды титруют в уксуснокислой среде, адсорбционный индикатор – эозинат натрия (метод Фаянса). Конечная точка титрования – поверхность коллоидных частиц резко изменяется из желтой в розовую.