- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Кристаллические и аморфные вещества
Содержание
- 2. Агрегатное состояние вещества (на примере кислорода О2)- 218,8°- 194°0°t°, CТ плТ киптвердоежидкоегаз
- 3. Особенности кристаллических веществСтрогое расположение частиц, образующих кристаллическую решетку Строго определенные Тпл и ТкипУзлы кристаллическойрешетки
- 4. Типы кристаллических решеток
- 5. Ионная кристаллическая решеткаВ узлах решетки ионы.Химическая связь
- 6. Атомная кристаллическая решеткаВ узлах решетки атомы.Химическая связь
- 7. Молекулярная кристаллическая решеткаВ узлах решетки молекулы.Химическая связь
- 8. Молекулярная кристаллическая решеткаБелый фосфор Р4Сера S8
- 9. Металлическая кристаллическая решеткаВ узлах решетки атом-ионы.Химическая связь
- 10. Закон постоянства состава (Пруст, 1799-1803)Молекулярные химические
- 11. Особенности аморфных веществНет строгого расположения частиц, нет кристаллической решетки.Нет строго определенных Тпл и Ткип
- 12. Аморфные вещества
- 13. Аморфные вещества
- 14. Аморфные вещества
- 15. Аморфные вещества
- 16. Аморфные вещества
- 17. Аморфные вещества
- 18. Аморфные вещества
- 19. Задание. Определите тип кристаллической решетки в веществахKNO3NO2CH4SiFeNaFAs
- 20. Скачать презентацию
- 21. Похожие презентации
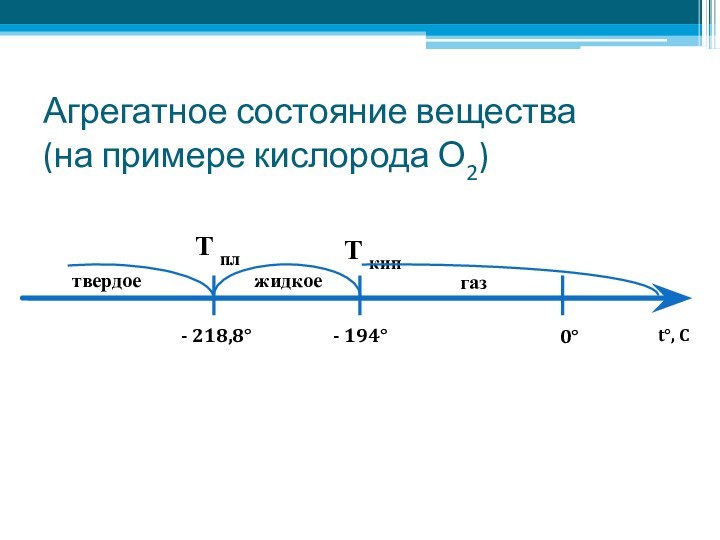
Агрегатное состояние вещества (на примере кислорода О2)- 218,8°- 194°0°t°, CТ плТ киптвердоежидкоегаз
















Слайд 3
Особенности кристаллических веществ
Строгое расположение частиц, образующих кристаллическую решетку
Строго определенные Тпл и Ткип
Узлы кристаллической
решетки
Слайд 5
Ионная кристаллическая решетка
В узлах решетки ионы.
Химическая связь ионная.
Свойства
веществ: 1) относительно высокая твердость, прочность, 2) хрупкость, 3)
термостойкость, 4) тугоплавкость, 5) нелетучестьПримеры: соли (NaCl, K2CO3), основания (Ca(OH)2, NaOH)
Слайд 6
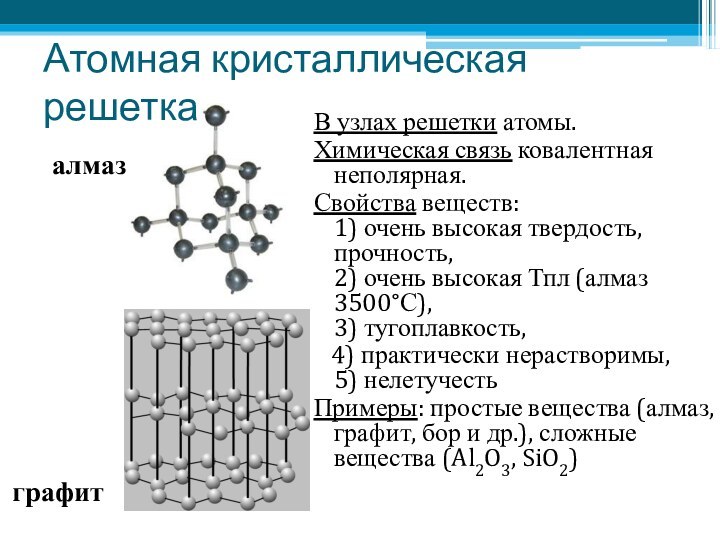
Атомная кристаллическая решетка
В узлах решетки атомы.
Химическая связь ковалентная
неполярная.
Свойства веществ:
1) очень высокая твердость, прочность,
2) очень
высокая Тпл (алмаз 3500°С),
3) тугоплавкость,4) практически нерастворимы, 5) нелетучесть
Примеры: простые вещества (алмаз, графит, бор и др.), сложные вещества (Al2O3, SiO2)
алмаз
графит
Слайд 7
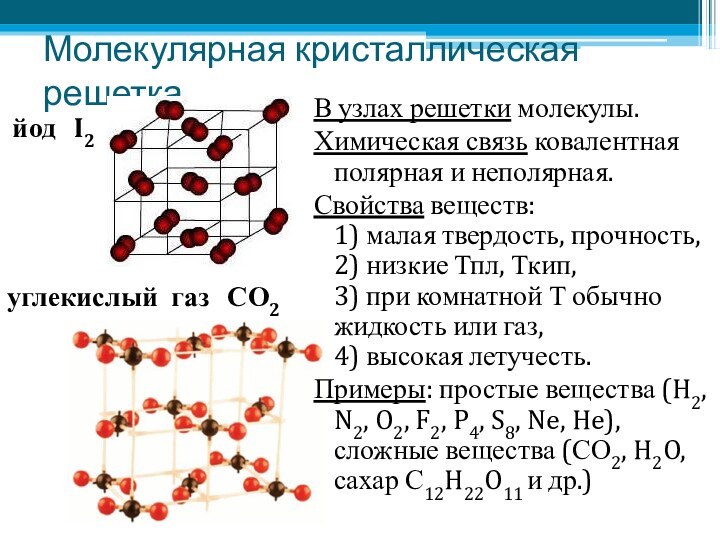
Молекулярная кристаллическая решетка
В узлах решетки молекулы.
Химическая связь ковалентная
полярная и неполярная.
Свойства веществ:
1) малая твердость, прочность,
2)
низкие Тпл, Ткип,
3) при комнатной Т обычно жидкость или газ,
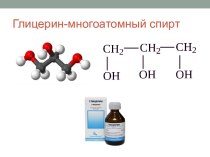
4) высокая летучесть.Примеры: простые вещества (H2, N2, O2, F2, P4, S8, Ne, He), сложные вещества (СО2, H2O, сахар С12H22O11 и др.)
йод I2
углекислый газ СО2
Слайд 9
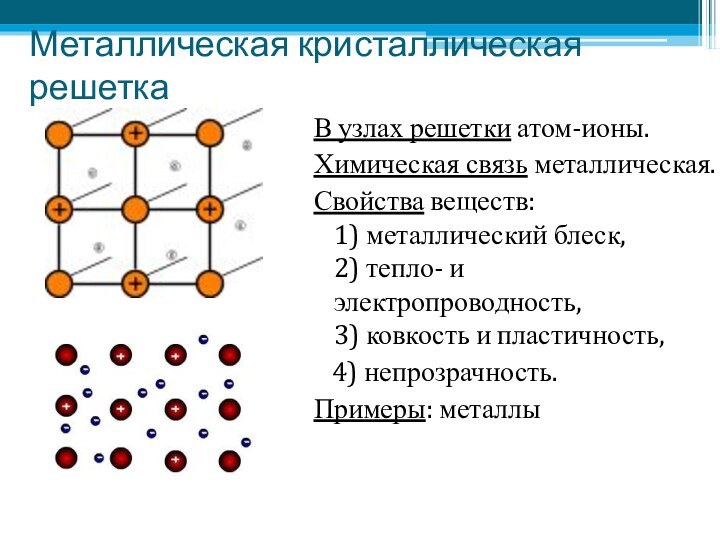
Металлическая кристаллическая решетка
В узлах решетки атом-ионы.
Химическая связь металлическая.
Свойства
веществ: 1) металлический блеск, 2) тепло- и электропроводность, 3) ковкость
и пластичность,4) непрозрачность.
Примеры: металлы