- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии Алканы (9 класс)
Содержание
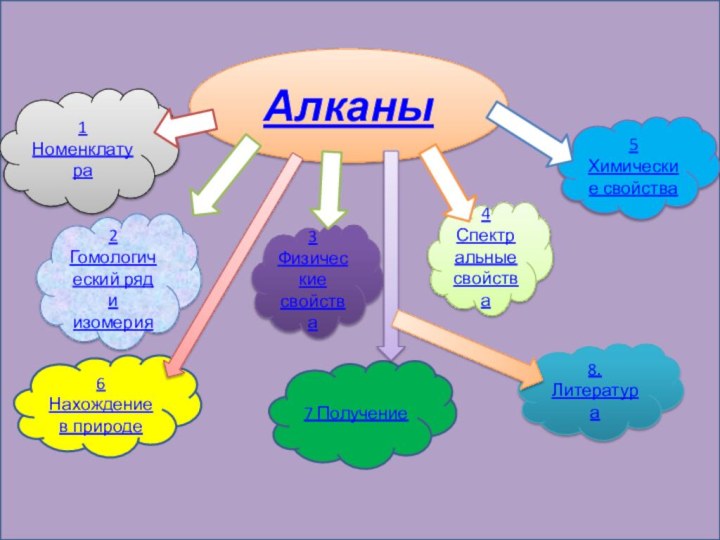
- 2. Алканы1 Номенклатура 2 Гомологический ряд и изомерия3
- 3. АлканыАлка́ны (также насыщенные алифатические углеводороды, парафины) — ациклические
- 4. 1 Номенклатура РациональнаяСистематическая ИЮПАКВыбирается один из атомов
- 5. 2 Гомологический ряд и изомериягомологи — это
- 6. 3 Физические свойстваТемпературы плавления и кипения увеличиваются
- 7. 4 Спектральные свойстваИК-спектроскопияУФ-спектроскопияЧистые алканы не поглощают в
- 8. 5 Химические свойства5.1 Реакции радикального замещения5.2 Реакции
- 9. 5.1.1 ГалогенированиеГалогенирование: СН4 + С12 —> СН3Сl
- 10. 5.1.2 Сульфохлорирование (реакция Рида)При облучении УФ-излучением алканы
- 11. Каталитическое окислениеВ реакциях каталитического окисления алканов могут
- 12. Термические превращения алкановРазложениеРеакции разложения происходят лишь под
- 13. Дегидрирование1) В углеродном скелете 2 (этан) или
- 14. 5.1.3 НитрованиеРеакция нитрования (реакция Коновалова)Реакция применяется для
- 15. 6 Нахождение в природеНахождение в космосеНахождение на
- 16. 7 ПолучениеВосстановление галогенпроизводных алканов:Восстановление спиртов:Гидрирование непредельных углеводородовСинтез КольбеВосстановление карбонильных соединенийРеакция ВюрцаСинтез Фишера — Тропша
- 17. Восстановление галогенпроизводных алканов:При каталитическом гидрировании в присутствии
- 18. Восстановление карбонильных соединенийРеакция Кижнера — Вольфа:Реакцию проводят в
- 19. Синтез КольбеПри электролизе солей карбоновых кислот, анион
- 20. Скачать презентацию
- 21. Похожие презентации
Слайд 3
Алканы
Алка́ны (также насыщенные алифатические углеводороды, парафины) — ациклические углеводороды
линейного или разветвлённого строения, содержащие только простые связи и
образующие гомологический ряд с общей формулой CnH2n+2.Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации — все 4 гибридные орбитали атома С идентичны по форме и энергии, 4 связи направлены в вершины тетраэдра под углами 109°28'. Связи C—C представляют собой σ-связи, отличающиеся низкой полярностью и поляризуемостью. Длина связи C—C составляет 0,154 нм, длина связи C—H — 0,1087 нм.
Слайд 4
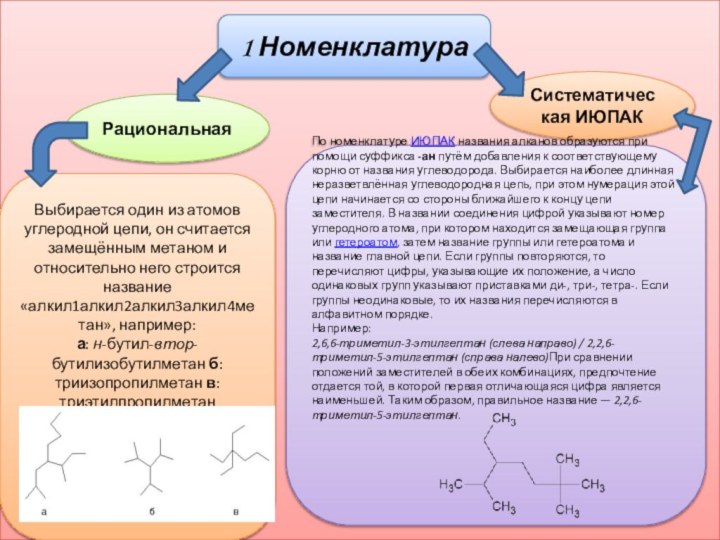
1 Номенклатура
Рациональная
Систематическая ИЮПАК
Выбирается один из атомов углеродной
цепи, он считается замещённым метаном и относительно него строится
название «алкил1алкил2алкил3алкил4метан», например:а: н-бутил-втор-бутилизобутилметан б: триизопропилметан в: триэтилпропилметан
По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь, при этом нумерация этой цепи начинается со стороны ближайшего к концу цепи заместителя. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающая группа или гетероатом, затем название группы или гетероатома и название главной цепи. Если группы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых групп указывают приставками ди-, три-, тетра-. Если группы неодинаковые, то их названия перечисляются в алфавитном порядке.
Например:
2,6,6-триметил-3-этилгептан (слева направо) / 2,2,6-триметил-5-этилгептан (справа налево)При сравнении положений заместителей в обеих комбинациях, предпочтение отдается той, в которой первая отличающаяся цифра является наименьшей. Таким образом, правильное название — 2,2,6-триметил-5-этилгептан.
Слайд 5
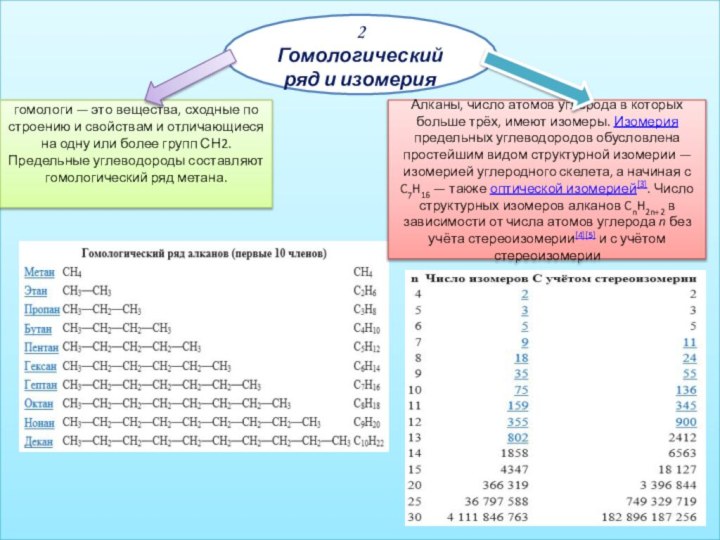
2 Гомологический ряд и изомерия
гомологи — это вещества,
сходные по строению и свойствам и отличающиеся на одну
или более групп СН2. Предельные углеводороды составляют гомологический ряд метана.Алканы, число атомов углерода в которых больше трёх, имеют изомеры. Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета, а начиная с C7H16 — также оптической изомерией[3]. Число структурных изомеров алканов CnH2n+2 в зависимости от числа атомов углерода n без учёта стереоизомерии[4][5] и с учётом стереоизомерии
Слайд 6
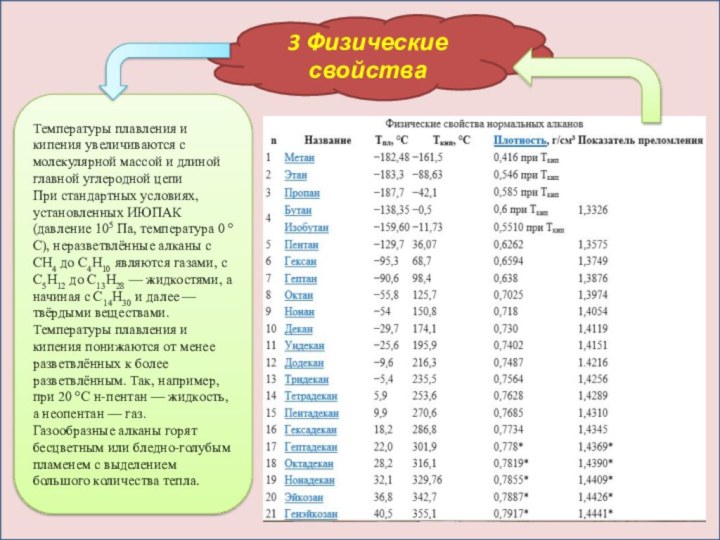
3 Физические свойства
Температуры плавления и кипения увеличиваются с
молекулярной массой и длиной главной углеродной цепи
При стандартных условиях,
установленных ИЮПАК(давление 105 Па, температура 0 °C), неразветвлённые алканы с CH4 до C4H10 являются газами, с C5H12 до C13H28 — жидкостями, а начиная с C14H30 и далее — твёрдыми веществами.Температуры плавления и кипения понижаются от менее разветвлённых к более разветвлённым. Так, например, при 20 °C н-пентан — жидкость, а неопентан — газ.
Газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла.
Слайд 7
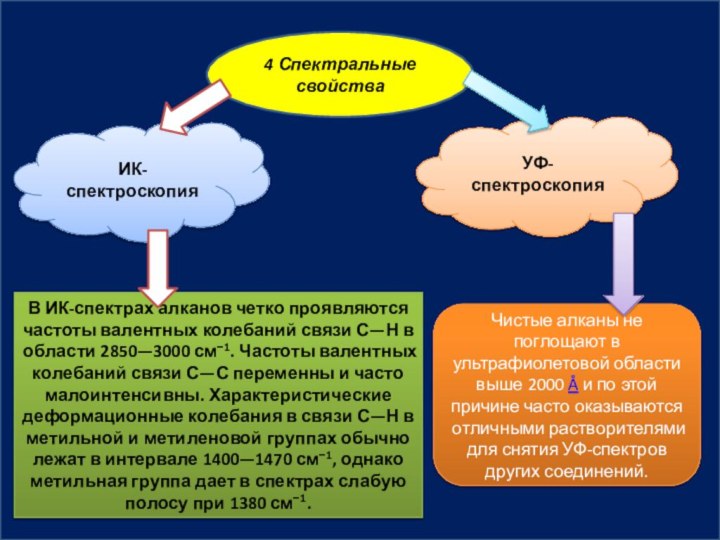
4 Спектральные свойства
ИК-спектроскопия
УФ-спектроскопия
Чистые алканы не поглощают в ультрафиолетовой
области выше 2000 Å и по этой причине часто
оказываются отличными растворителями для снятия УФ-спектров других соединений.В ИК-спектрах алканов четко проявляются частоты валентных колебаний связи С—Н в области 2850—3000 см−1. Частоты валентных колебаний связи С—С переменны и часто малоинтенсивны. Характеристические деформационные колебания в связи С—Н в метильной и метиленовой группах обычно лежат в интервале 1400—1470 см−1, однако метильная группа дает в спектрах слабую полосу при 1380 см−1.
Слайд 8
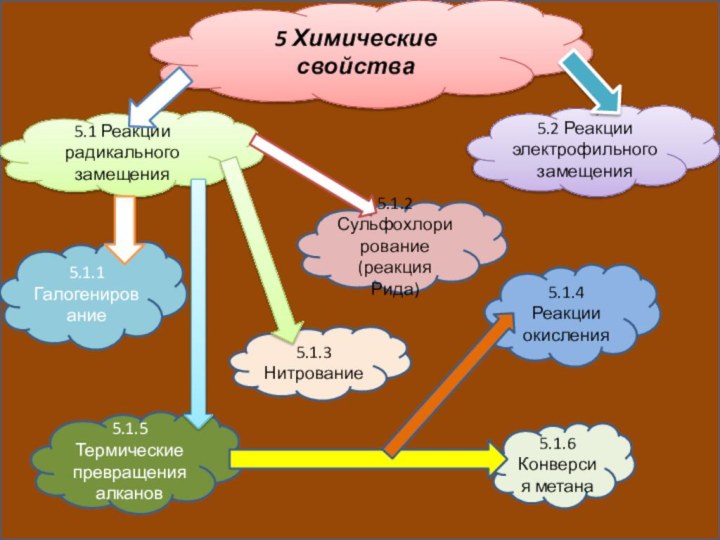
5 Химические свойства
5.1 Реакции радикального замещения
5.2 Реакции электрофильного
замещения
5.1.1 Галогенирование
5.1.2 Сульфохлорирование (реакция Рида)
5.1.3 Нитрование
5.1.4 Реакции окисления
5.1.5 Термические
превращения алканов5.1.6 Конверсия метана
Слайд 9
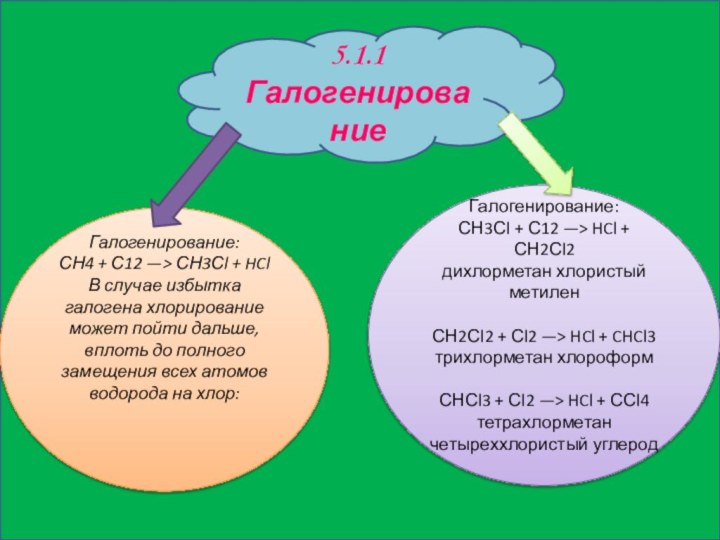
5.1.1 Галогенирование
Галогенирование:
СН4 + С12 —> СН3Сl + HCl
В
случае избытка галогена хлорирование может пойти дальше, вплоть до
полного замещения всех атомов водорода на хлор:Галогенирование:
СН3Сl + С12 —> HCl + СН2Сl2
дихлорметан хлористый метилен
СН2Сl2 + Сl2 —> HCl + CHCl3
трихлорметан хлороформ
СНСl3 + Сl2 —> HCl + ССl4
тетрахлорметан четыреххлористый углерод
Слайд 10
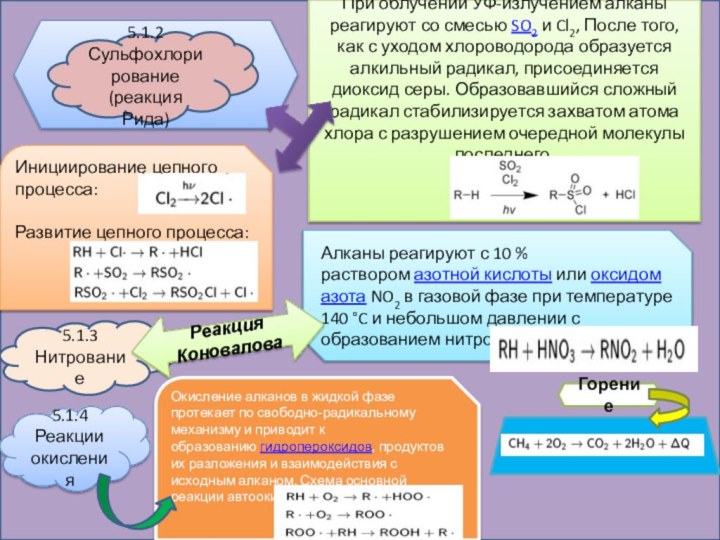
5.1.2 Сульфохлорирование (реакция Рида)
При облучении УФ-излучением алканы реагируют
со смесью SO2 и Cl2, После того, как с уходом хлороводорода
образуется алкильный радикал, присоединяется диоксид серы. Образовавшийся сложный радикал стабилизируется захватом атома хлора с разрушением очередной молекулы последнего.
Инициирование цепного процесса:
Развитие цепного процесса:
5.1.3 Нитрование
Алканы реагируют с 10 % раствором азотной кислоты или оксидом азота NO2 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных:
Реакция Коновалова
5.1.4 Реакции окисления
Окисление алканов в жидкой фазе протекает по свободно-радикальному механизму и приводит к образованию гидропероксидов, продуктов их разложения и взаимодействия с исходным алканом. Схема основной реакции автоокисления:
Горение
Слайд 11
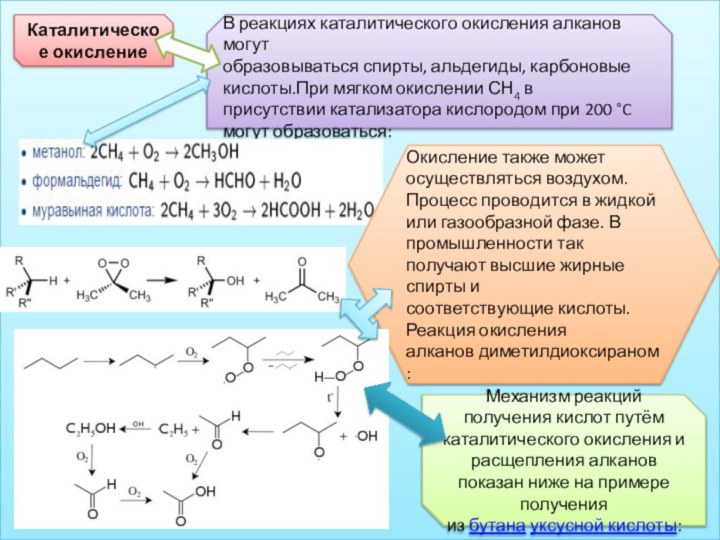
Каталитическое окисление
В реакциях каталитического окисления алканов могут образовываться спирты, альдегиды, карбоновые
кислоты.При мягком окислении СН4 в присутствии катализатора кислородом при 200 °C могут образоваться:
Окисление
также может осуществляться воздухом. Процесс проводится в жидкой или газообразной фазе. В промышленности так получают высшие жирные спирты и соответствующие кислоты.Реакция окисления алканов диметилдиоксираном:
Механизм реакций получения кислот путём каталитического окисления и расщепления алканов показан ниже на примере получения из бутана уксусной кислоты:
Слайд 12
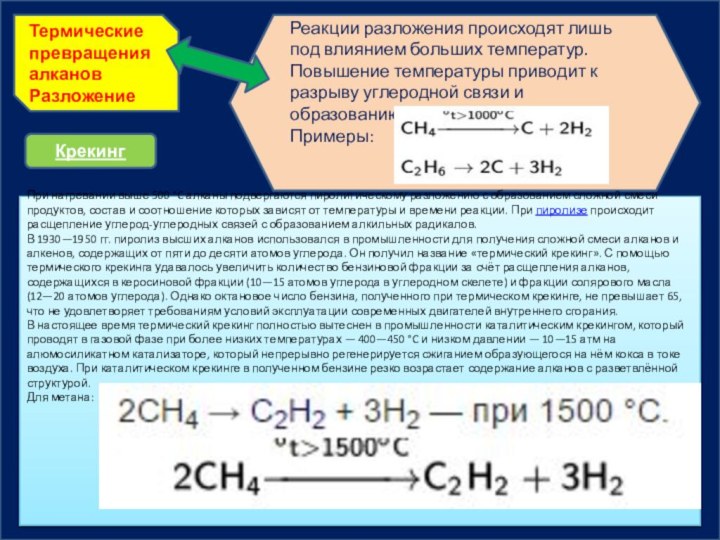
Термические превращения алканов
Разложение
Реакции разложения происходят лишь под влиянием
больших температур. Повышение температуры приводит к разрыву углеродной связи
и образованию свободных радикалов.Примеры:
Крекинг
При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов.
В 1930—1950 гг. пиролиз высших алканов использовался в промышленности для получения сложной смеси алканов и алкенов, содержащих от пяти до десяти атомов углерода. Он получил название «термический крекинг». С помощью термического крекинга удавалось увеличить количество бензиновой фракции за счёт расщепления алканов, содержащихся в керосиновой фракции (10—15 атомов углерода в углеродном скелете) и фракции солярового масла (12—20 атомов углерода). Однако октановое число бензина, полученного при термическом крекинге, не превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания.
В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах — 400—450 °C и низком давлении — 10—15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
Для метана:
Слайд 13
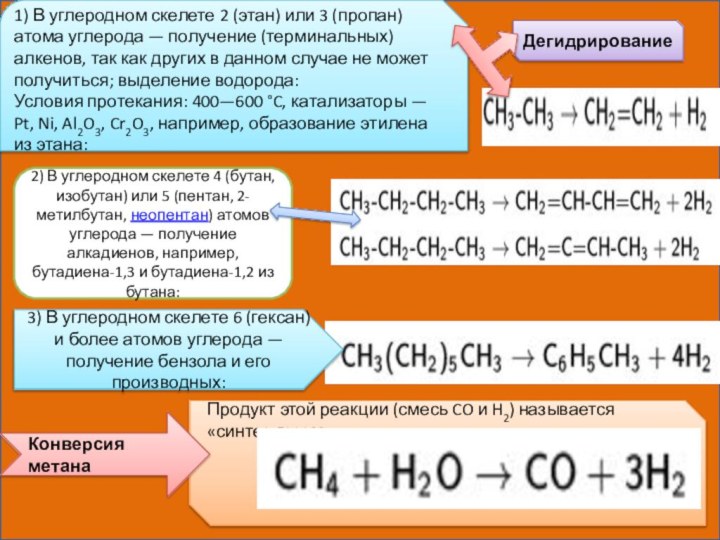
Дегидрирование
1) В углеродном скелете 2 (этан) или 3
(пропан) атома углерода — получение (терминальных) алкенов, так как других
в данном случае не может получиться; выделение водорода:Условия протекания: 400—600 °C, катализаторы — Pt, Ni, Al2O3, Cr2O3, например, образование этилена из этана:
2) В углеродном скелете 4 (бутан, изобутан) или 5 (пентан, 2-метилбутан, неопентан) атомов углерода — получение алкадиенов, например, бутадиена-1,3 и бутадиена-1,2 из бутана:
3) В углеродном скелете 6 (гексан) и более атомов углерода — получение бензола и его производных:
Продукт этой реакции (смесь CO и H2) называется «синтез-газом».
Конверсия метана
Слайд 14
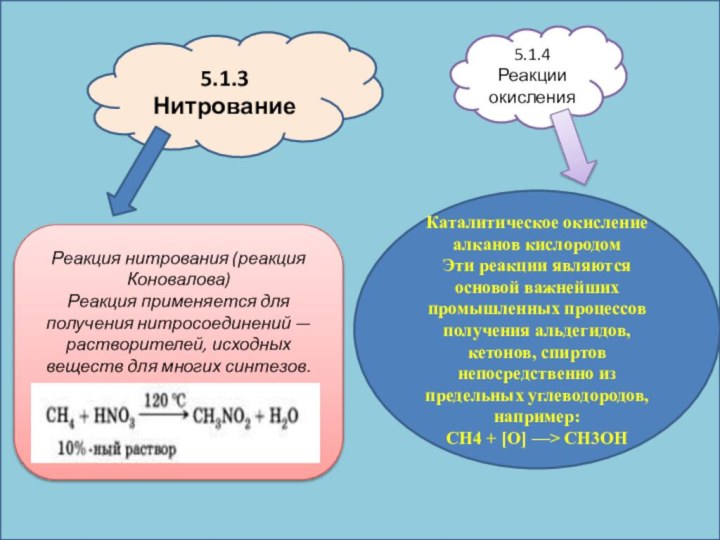
5.1.3 Нитрование
Реакция нитрования (реакция Коновалова)
Реакция применяется для получения
нитросоединений — растворителей, исходных веществ для многих синтезов.
5.1.4 Реакции
окисленияКаталитическое окисление алканов кислородом
Эти реакции являются основой важнейших промышленных процессов получения альдегидов, кетонов, спиртов непосредственно из предельных углеводородов, например:
СН4 + [О] —> СН3ОН
Слайд 15
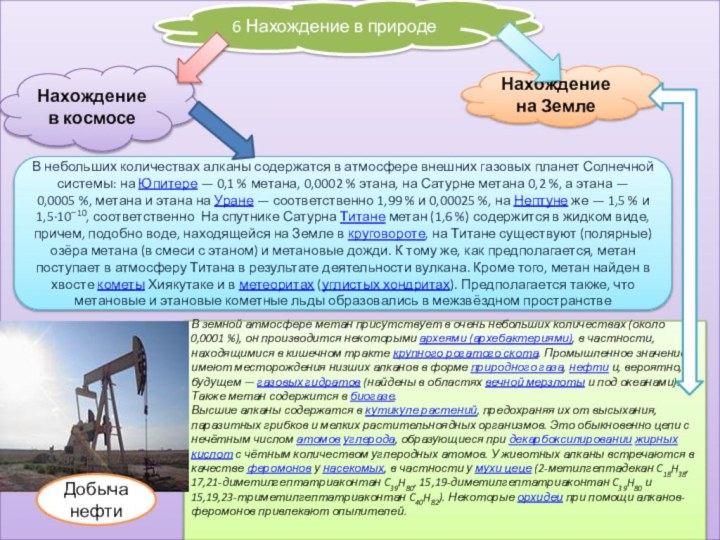
6 Нахождение в природе
Нахождение в космосе
Нахождение на Земле
В
небольших количествах алканы содержатся в атмосфере внешних газовых планет
Солнечной системы: на Юпитере — 0,1 % метана, 0,0002 % этана, на Сатурне метана 0,2 %, а этана — 0,0005 %, метана и этана на Уране — соответственно 1,99 % и 0,00025 %, на Нептуне же — 1,5 % и 1,5·10−10, соответственно На спутнике Сатурна Титане метан (1,6 %) содержится в жидком виде, причем, подобно воде, находящейся на Земле в круговороте, на Титане существуют (полярные) озёра метана (в смеси с этаном) и метановые дожди. К тому же, как предполагается, метан поступает в атмосферу Титана в результате деятельности вулкана. Кроме того, метан найден в хвосте кометы Хиякутаке и в метеоритах (углистых хондритах). Предполагается также, что метановые и этановые кометные льды образовались в межзвёздном пространствеВ земной атмосфере метан присутствует в очень небольших количествах (около 0,0001 %), он производится некоторыми археями (архебактериями), в частности, находящимися в кишечном тракте крупного рогатого скота. Промышленное значение имеют месторождения низших алканов в форме природного газа, нефти и, вероятно, в будущем — газовых гидратов (найдены в областях вечной мерзлоты и под океанами). Также метан содержится в биогазе.
Высшие алканы содержатся в кутикуле растений, предохраняя их от высыхания, паразитных грибков и мелких растительноядных организмов. Это обыкновенно цепи с нечётным числом атомов углерода, образующиеся при декарбоксилировании жирных кислот с чётным количеством углеродных атомов. У животных алканы встречаются в качестве феромонов у насекомых, в частности у мухи цеце (2-метилгептадекан C18H38, 17,21-диметилгептатриаконтан C39H80, 15,19-диметилгептатриаконтан C39H80 и 15,19,23-триметилгептатриаконтан C40H82). Некоторые орхидеи при помощи алканов-феромонов привлекают опылителей.
Добыча нефти
Слайд 16
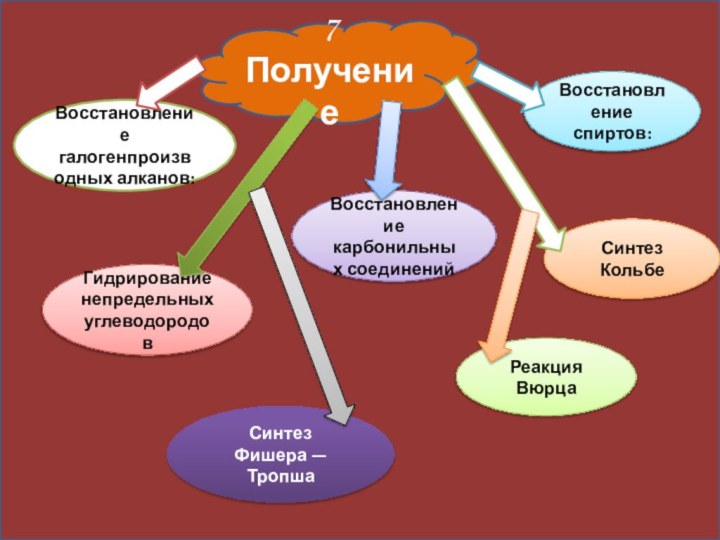
7 Получение
Восстановление галогенпроизводных алканов:
Восстановление спиртов:
Гидрирование непредельных углеводородов
Синтез Кольбе
Восстановление
карбонильных соединений
Реакция Вюрца
Синтез Фишера — Тропша
Слайд 17
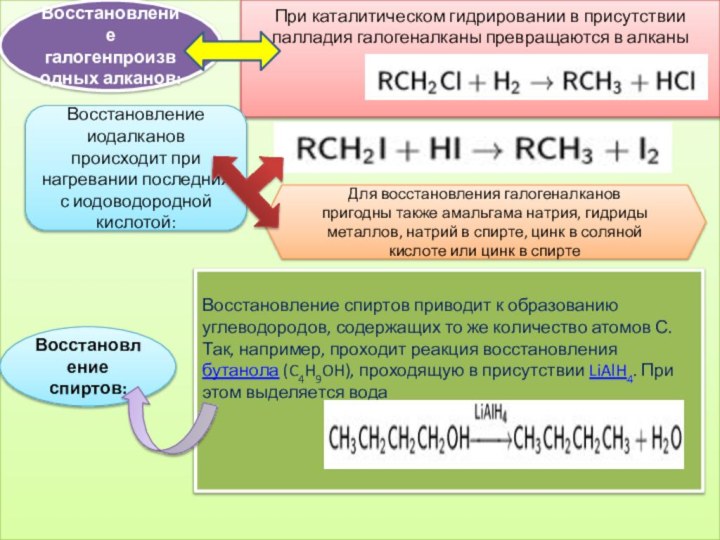
Восстановление галогенпроизводных алканов:
При каталитическом гидрировании в присутствии палладия
галогеналканы превращаются в алканы
Восстановление спиртов:
Восстановление спиртов приводит к образованию
углеводородов, содержащих то же количество атомов С. Так, например, проходит реакция восстановления бутанола (C4H9OH), проходящую в присутствии LiAlH4. При этом выделяется водаВосстановление иодалканов происходит при нагревании последних с иодоводородной кислотой:
Для восстановления галогеналканов пригодны также амальгама натрия, гидриды металлов, натрий в спирте, цинк в соляной кислоте или цинк в спирте
Слайд 18
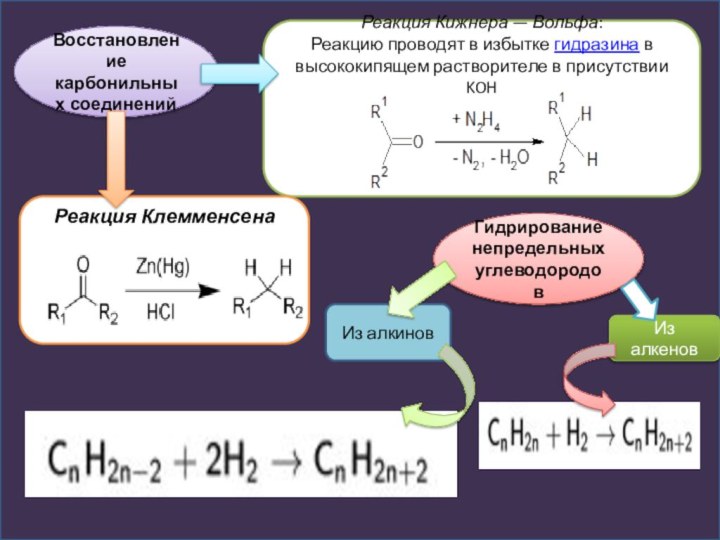
Восстановление карбонильных соединений
Реакция Кижнера — Вольфа:
Реакцию проводят в избытке
гидразина в высококипящем растворителе в присутствии KOH
Реакция Клемменсена
Гидрирование непредельных
углеводородовИз алкенов
Из алкинов
Слайд 19
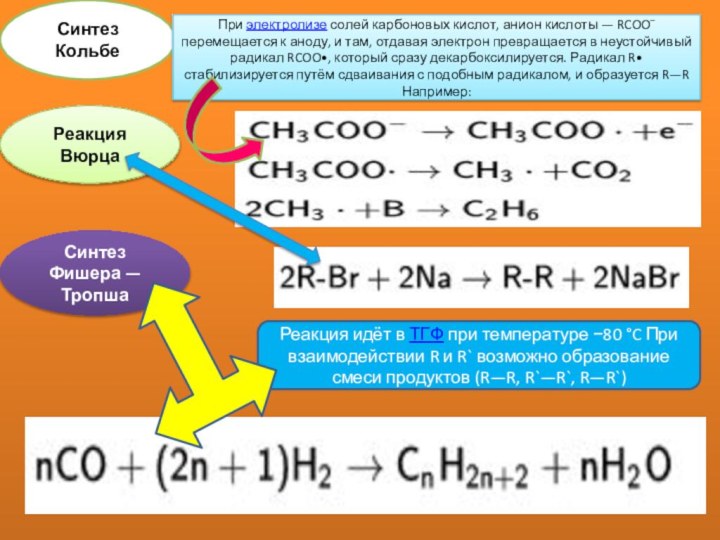
Синтез Кольбе
При электролизе солей карбоновых кислот, анион кислоты —
RCOO− перемещается к аноду, и там, отдавая электрон превращается
в неустойчивый радикал RCOO•, который сразу декарбоксилируется. Радикал R• стабилизируется путём сдваивания с подобным радикалом, и образуется R—R Например:Реакция Вюрца
Реакция идёт в ТГФ при температуре −80 °C При взаимодействии R и R` возможно образование смеси продуктов (R—R, R`—R`, R—R`)
Синтез Фишера — Тропша