- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Алюминий
Содержание
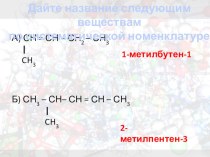
- 2. Алюминий — элемент главной подгруппы III группы), третьего
- 3. Строение атома алюминия
- 4. История открытия Впервые Al был получен датским
- 5. Применение1) Применяется в одной из отраслей металлургии
- 6. Физические свойства1) Самый распространенный металл в природе.2)
- 7. Химические свойства1) Алюминий активен, но при нормальных
- 8. 1. Окисление: 4Al + 3O2
- 9. 3. Взаимодействие с разбавленными
- 10. 5. Алюминий – восстанавливает многие металлы из
- 11. Скачать презентацию
- 12. Похожие презентации
Алюминий — элемент главной подгруппы III группы), третьего периода, с атомным номером 13. Обозначается символом Al(лат. Aluminium). Относится к группе лёгких металлов. Наиболее распространённый металл и третий по распространённости химический элемент в земной коре (после кислорода и кремния).










Слайд 4
История открытия
Впервые Al был получен датским физиком
Эрстедом Х. в 1825 г. Название элемента происходит от
лат. алюмен, так в древности называли квасцы, которые использовали для крашения тканей (KAl(SO4)2 . 12H2O).Позже в 1827 г. немецкий химик
Фридрих Велер получил алюминий
следующим способом:
AlCl3+3K t 3KCl + Al
Слайд 5
Применение
1) Применяется в одной из отраслей металлургии –
алюмотермии
2) Алюминаты используются во многих отраслях промышленности
3) В авиапромышленности
4)
В фармацевтики5) Для дубления кож
6) Для крашения тканей
Слайд 6
Физические свойства
1) Самый распространенный металл в природе.
2) Легкий
3)
Серебристо-белый
4) Пластичный
5) Не имеет характерного металлического блеска (покрыт тонкой
белой пленкой из оксида алюминия)6) По электропроводности превосходит другие металлы, кроме серебра и меди
7) Температура плавления – 6600С
8) Образует с другими металлами легкие, но прочные сплавы
Слайд 7
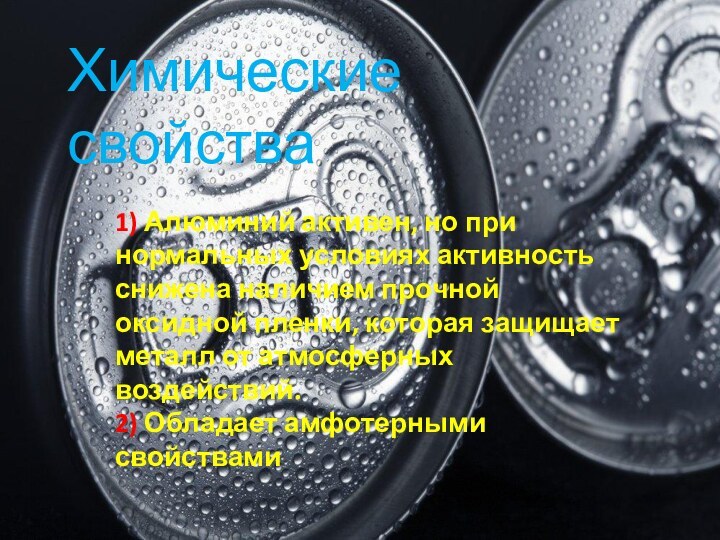
Химические свойства
1) Алюминий активен, но при нормальных условиях
активность снижена наличием прочной оксидной пленки, которая защищает металл
от атмосферных воздействий.2) Обладает амфотерными свойствами
Слайд 9
3. Взаимодействие с разбавленными
кислотами:
2Al +
6HCl 2AlCl3 + 3H24. Взаимодействие с водными растворами
щелочей:
2Al + 2NaOH + 2H2O 2NaAlO2 + 3H2
алюминат натрия
Слайд 10 5. Алюминий – восстанавливает многие металлы из оксидов
(алюминотермия):
8Al + 3Fe3O4 4Al2O3 +
9Fe + Q6. Если в отсутствии воздуха удалить с поверхности алюминия оксидную пленку, то он активно реагирует с водой.
2Al + 6H2O=2H2 + 2Al(OH)3