- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Азот и фосфор-р-элементы VA-группы
Содержание
- 2. В VA-группе периодической системе расположены неметаллы азот
- 3. У атомов элементов VA-группы на внешнем электронном
- 4. Азот в природеАзот обозначается символом N (лат.
- 5. Азот в космосеВне пределов Земли азот обнаружен
- 6. Фосфор в природеФосфор в природе встречается в
- 7. Простое вещество азот состоит из двухатомных молекул
- 8. В свободном состоянии фосфор образует несколько аллотропных модификаций, которые называются белым, красным и черным фосфором.Фосфор
- 9. В простейшей молекуле Р4 каждый из четырех
- 10. Химически белый фосфор чрезвычайно активен! Например,
- 11. Красный фосфор имеет атомную полимерную структуру, в
- 12. При нагревании под давлением примерно в 1200
- 13. В 1830 году французский химик Шарль Сориа
- 14. Простейшее вещество азот N2 химически малоактивно и,
- 15. Окислительные свойства фосфора проявляются при его взаимодействии
- 16. Фосфор также окисляется кислородом, проявляя при этом
- 17. Горение белого фосфора
- 18. Наиболее активен химически, токсичен и горюч белый
- 19. Появление блуждающих огней на старых кладбищах и
- 20. Основная область применения азота – производство аммиака.
- 21. Красный фосфор используют для производства спичек, фосфорной
- 22. Домашнее задание: Параграф §49.
- 23. Скачать презентацию
- 24. Похожие презентации

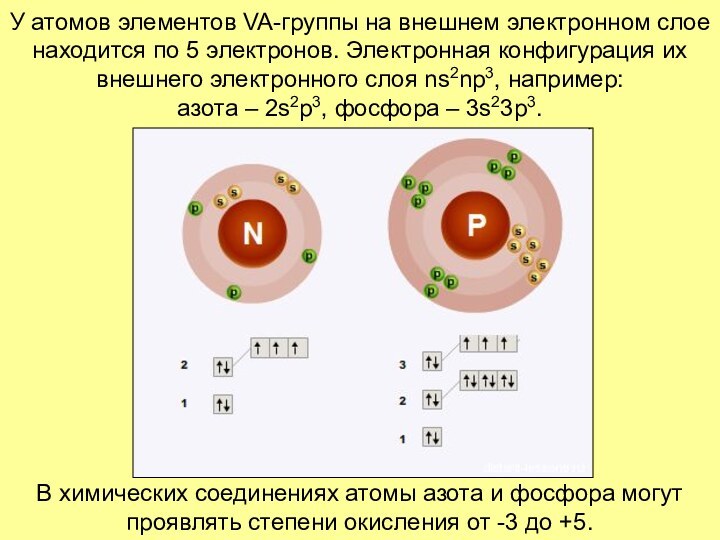

















Слайд 3 У атомов элементов VA-группы на внешнем электронном слое
находится по 5 электронов. Электронная конфигурация их внешнего электронного
слоя ns2np3, например: азота – 2s2p3, фосфора – 3s23p3.В химических соединениях атомы азота и фосфора могут проявлять степени окисления от -3 до +5.
Слайд 4
Азот в природе
Азот обозначается символом N
(лат. Nitrogenium,
т.е. «рождающий селитру).
Простое вещество азот (N2) — достаточно
инертный при нормальных условиях газ без цвета, вкуса и запаха.Азот, в форме двухатомных молекул N2 составляет большую часть атмосферы, где его содержание составляет 78,084% по объёму (то есть около 3,87·1015 т).
Слайд 5
Азот в космосе
Вне пределов Земли азот обнаружен в
газовых туманностях, солнечной атмосфере, на Уране, Нептуне, межзвёздном пространстве
и др. Азот — 4й по распространённости элемент Солнечной системы (после водорода, гелия и кислорода).
Слайд 6
Фосфор в природе
Фосфор в природе встречается в основном
в виде фосфатов. Так, фосфат кальция Са3(PO4)2 является основным
компонентом минерала апатита.Фосфор содержится во всех частях зелёных растений, ещё больше его в плодах и семенах.
Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни.
Апатит
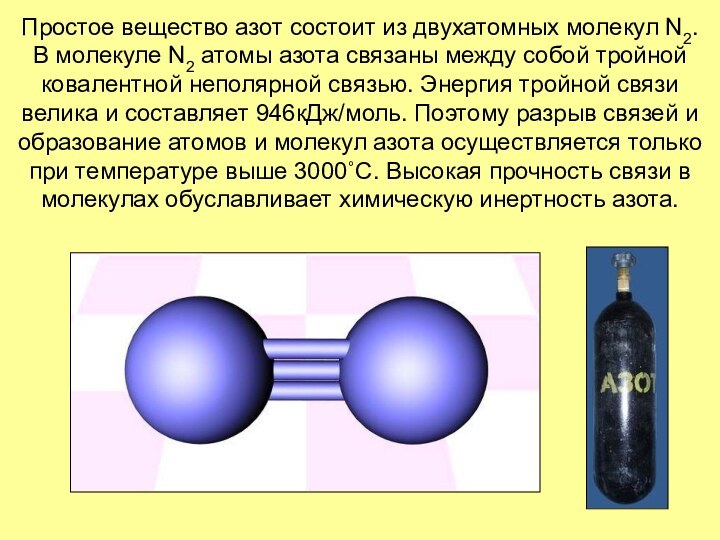
Слайд 7 Простое вещество азот состоит из двухатомных молекул N2.
В молекуле N2 атомы азота связаны между собой тройной
ковалентной неполярной связью. Энергия тройной связи велика и составляет 946кДж/моль. Поэтому разрыв связей и образование атомов и молекул азота осуществляется только при температуре выше 3000˚С. Высокая прочность связи в молекулах обуславливает химическую инертность азота.Слайд 8 В свободном состоянии фосфор образует несколько аллотропных модификаций,
которые называются белым, красным и черным фосфором.
Фосфор
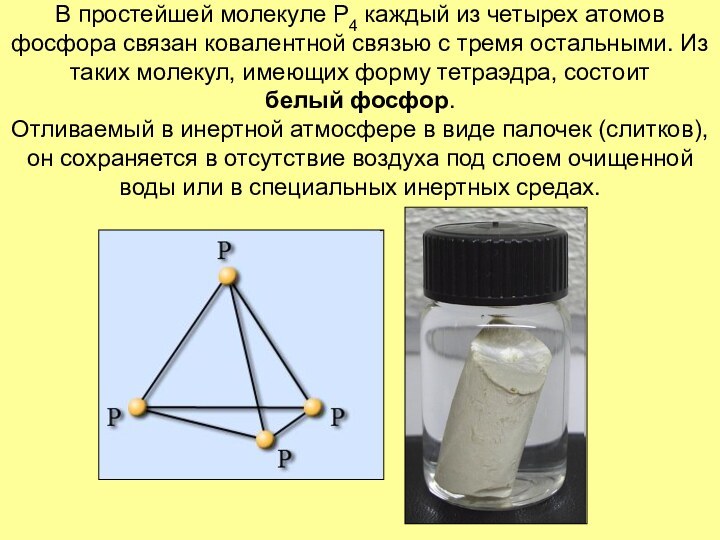
Слайд 9 В простейшей молекуле Р4 каждый из четырех атомов
фосфора связан ковалентной связью с тремя остальными. Из таких
молекул, имеющих форму тетраэдра, состоит белый фосфор. Отливаемый в инертной атмосфере в виде палочек (слитков), он сохраняется в отсутствие воздуха под слоем очищенной воды или в специальных инертных средах.Слайд 10 Химически белый фосфор чрезвычайно активен! Например, он медленно
окисляется кислородом воздуха уже при комнатной температуре и светится
(бледно-зелёное свечение). Явление такого рода свечения вследствие химических реакций окисления называется хемилюминесценцией (иногда ошибочно фосфоресценцией). Белый фосфор весьма ядовит . Летальная доза белого фосфора для взрослого мужчины составляет 0,05—0,1 г.Слайд 11 Красный фосфор имеет атомную полимерную структуру, в которой
каждый атом фосфора связан с тремя другими атомами ковалентными
связями. Красный фосфор не летуч, не растворим в воде, не ядовит. Он используется в производстве спичек.На свету и при нагревании до 300˚С без доступа воздуха белый фосфор превращается в красный фосфор.
Слайд 12 При нагревании под давлением примерно в 1200 раз
большим, чем атмосферное давление, белый фосфор переходит в черный
фосфор, который имеет атомную слоистую кристаллическую решетку. Черный фосфор по своим физическим свойствам похож на металл: он проводит электрический ток и блестит. Внешне весьма похож на графит. Чёрный фосфор — это химически наименее активная форма фосфора.Слайд 13 В 1830 году французский химик Шарль Сориа изобрёл
фосфорные спички, состоявшие из смеси бертолетовой соли, белого фосфора
и клея. Эти спички были весьма огнеопасны, поскольку загорались даже от взаимного трения в коробке и при трении о любую твёрдую поверхность, например, подошву сапога. Из-за белого фосфора они были ядовиты. В 1855 году шведский химик Йохан Лундстрем нанёс красный фосфор на поверхность наждачной бумаги и заменил им же белый фосфор в составе головки спички. Такие спички уже не приносили вреда здоровью, легко зажигались о заранее приготовленную поверхность и практически не самовоспламенялись. Йохан Лундстрем патентует первую «шведскую спичку», дошедшую практически до наших дней. В 1855 году спички Лундстрема были удостоены медали на Всемирной выставке в Париже. Позднее фосфор был полностью выведен из состава головок спичек и оставался только в составе намазки (тёрки). С развитием производства «шведских» спичек, производство спичек с использованием белого фосфора было запрещено почти во всех странах.Слайд 14 Простейшее вещество азот N2 химически малоактивно и, как
правило, вступает в химические реакции только при высоких температурах. Окислительные
свойства азота проявляются в реакции с водородом и активными металлами. Так, водород с азотом соединяется в присутствии катализатора при высокой температуре и большом давлении, образуя аммиак:Из металлов при обычных условиях азот реагирует только с литием, образуя нитрид лития:
Слайд 15 Окислительные свойства фосфора проявляются при его взаимодействии с
наиболее активными металлами:
Восстановительные свойства азота и фосфора проявляются при
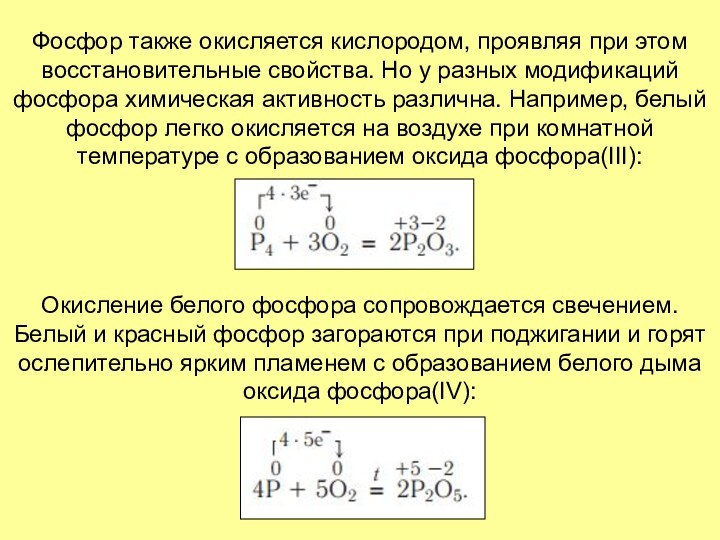
их взаимодействии с кислородом. Так, азот реагирует с кислородом при температуре около 3000˚С, образуя оксид азота (II):Слайд 16 Фосфор также окисляется кислородом, проявляя при этом восстановительные
свойства. Но у разных модификаций фосфора химическая активность различна.
Например, белый фосфор легко окисляется на воздухе при комнатной температуре с образованием оксида фосфора(III):Окисление белого фосфора сопровождается свечением. Белый и красный фосфор загораются при поджигании и горят ослепительно ярким пламенем с образованием белого дыма оксида фосфора(IV):
Слайд 18 Наиболее активен химически, токсичен и горюч белый фосфор.
Потому он очень часто применяется в зажигательных бомбах. К сожалению,
фосфорные боеприпасы применяются и в XXI веке! - во время осады Сараево фосфорные снаряды применялись артиллерией боснийских сербов. В 1992 году такими снарядами было сожжено здание Института востоковедения, в результате чего погибло множество исторических документов.
- в 2003-2004 годах применялись британскими спецслужбами в окрестностях Басры в Ираке.
- в 2004 году применялись США против партизанского подполья в Ираке в сражении за Фаллуджу.
летом 2006 года, в ходе Второй Ливанской войны артиллерийские снаряды с белым фосфором применяла израильская армия.
в 2009 году в ходе операции «Литой свинец» в секторе Газа израильская армия применяла боеприпасы, содержащие белый фосфор, допускаемые международным законодательством.
- с 2009 палестинские террористы заряжали свои ракеты белым фосфором.
Слайд 19 Появление блуждающих огней на старых кладбищах и болотах
вызвано воспламенением на воздухе фосфина PH3 и других соединений,
содержащих фосфор. На воздухе продукты соединения фосфора с водородом самовоспламеняются с образованием светящегося пламени и капелек фосфорной кислоты – продукта взаимодействия оксида фосфора(V) с водой. Эти капельки создают размытый контур «привидения».Слайд 20 Основная область применения азота – производство аммиака. Азот
применяют также для создания инертной среды при сушке взрывчатых
веществ, при хранении ценных произведений живописи и рукописей. Кроме того, азотом наполняют электрические лампы накаливания.Применение простых веществ
Производство
аммиака
Большинство современных ламп наполняются химически инертными газами. Смеси азота N2 с аргоном Ar являются наиболее распространёнными в силу малой себестоимости.





























